Suivez-nous sur les réseaux sociaux !
Dernières publications
Publications
Chapitre 10 – Item 153 : Surveillance des porteurs de valve et prothèses vasculaires
I. Les différents types de prothèses valvulaires
II. Physiopathologie
III. Complications des valves cardiaques
IV. Surveillance des porteurs de valve cardiaque
Situations de départ
18 Découverte d’anomalies à l’auscultation cardiaque.
20 Découverte d’anomalies à l’auscultation pulmonaire.
21 Asthénie.
22 Diminution de la diurèse.
44 Hyperthermie/fièvre.
50 Malaise/perte de connaissance.
58 Splénomégalie.
59 Tendance au saignement.
60 Hémorragie aiguë.
89 Purpura/ecchymoses/hématome.
102 Hématurie.
121 Déficit neurologique sensitif et/ou moteur.
147 Épistaxis.
160 Détresse respiratoire aiguë.
161 Douleurs thoraciques.
162 Dyspnée.
165 Palpitations.
166 Tachycardie.
178 Demande/prescription raisonnée et choix d’un examen diagnostique.
185 Réalisation réinterprétation d’un électrocardiogramme (ECG).
190 Hémoculture positive.
203 Élévation de la protéine C-réactive (CRP).
217 Baisse de l’hémoglobine.
248 Prescription et suivi d’un traitement par anticoagulant et/ou antiagrégant.
255 Prescrire un anti-infectieux.
285 Consultation de suivi et éducation thérapeutique d’un patient avec un antécédent cardiovasculaire.
352 Expliquer un traitement au patient (adulte/enfance/adolescent).
354 Évaluation de l’observance thérapeutique.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé | Descriptif |
|---|---|---|---|
| Définition | Différents types de prothèses valvulaires | Prothèses mécaniques, bioprothèses chirurgicales et percutanées | |
| Définition | Principales complications des prothèses valvulaires | Savoir les énumérer | |
| Suivi et/ou pronostic | Modalités de surveillance des porteurs de prothèses valvulaires | ||
| Identifier une urgence | Savoir que tout patient porteur d’une prothèse valvulaire est un sujet à risque infectieux (endocardite infectieuse, greffe) | ||
| Suivi et/ou pronostic | Connaître les valeurs cibles d’INR en fonction des prothèses valvulaires et du terrain | ||
| Diagnostic positif | Connaître les modalités du diagnostic d’une désinsertion de prothèse valvulaire, incluant l’hémolyse | ||
I Les différents types de prothèses valvulaires
• ![]() Il existe 2 grands types de prothèses valvulaires : les prothèses mécaniques et les prothèses biologiques
Il existe 2 grands types de prothèses valvulaires : les prothèses mécaniques et les prothèses biologiques
• Parmi les prothèses biologiques (bioprothèses), on distingue les prothèses chirurgicales, implantées lors de la chirurgie, et les prothèses percutanées, implantées par cathétérisme interventionnel (TAVI ou TAVR : Transcatheter Aortic Valve Implantation ou Replacement).
• Les prothèses, étant par nature des corps étrangers, présentent un risque accru d’endocardite infectieuse par rapport aux valves natives.
A Prothèses mécaniques (cf. vidéo 10.1)
• Ce sont des dispositifs artificiels, construits actuellement en titane et carbone pour la partie mécanique, avec une collerette en tissu de type dacron pour la suture sur les tissus (cf. fig. 10.1).
• Les premières valves mécaniques étaient à bille (prothèse de Starr®), puis sont apparues des valves mono-disque (telle que les prothèses de Björk-Shiley®, Medtronic-Hall®), puis des prothèses à double ailette (prothèse de Saint-Jude®, Sorin Bicarbon®, Mira®, etc.). Les valves à double ailette, qui offrent une bonne hémodynamique et sont moins thrombogènes, sont les plus implantées.
• Certains patients opérés il y a plusieurs décennies sont encore porteurs de prothèses d’ancienne génération.
• Les valves cardiaques mécaniques présentent un risque de thrombose et nécessitent un traitement anticoagulant définitif par antivitamine K (AVK) qui expose donc aux risques de ce traitement (risque hémorragique). Les AVK diminuent mais ne suppriment pas totalement le risque thrombotique.
• Les anticoagulants oraux directs (antithrombine ou antifacteur X) sont formellement contre-indiqués en cas de prothèse mécanique, même de façon transitoire.
• En cas de besoin, un traitement relais peut faire appel à l’héparine non fractionnée ou aux héparines de bas poids moléculaire.
Ces prothèses ont une excellente durabilité et sont prévues pour durer toute la vie du patient.
Fig. 10.1 ![]() Différents types de prothèses chirurgicales mécaniques.
Différents types de prothèses chirurgicales mécaniques.
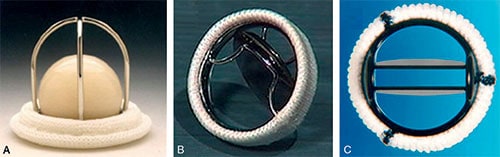
A. Prothèse à bille de type Starr®, retirée de la commercialisation en 2007. B. Prothèse à disque de type Björk-Shiley®. C. Prothèse à double ailette de type St-Jude®.
© Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound : a report From the American Society of Echocardiography’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009 ; 22 (9) : 975–1014.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
B Prothèses biologiques ou bioprothèses (cf. vidéo 10.2)
1 Bioprothèses chirurgicales
• Les valves biologiques sont le plus souvent des xénogreffes, valves d’origine animale (Hancock®, Carpentier-Edwards®, Perimount®, Mosaic, Magna Ease®, Inspiris Resilia®, Avalus®, etc.), constituées de péricarde principalement bovin ou de valves aortiques d’origine porcine (cf. fig. 10.2).
• Les valves biologiques sont plus rarement des allogreffes/homogreffes (surtout valve aortique prélevée chez un donneur) ou autogreffes d’origine humaine (intervention de Ross : remplacement du culot aortique par le culot pulmonaire du patient, puis implantation d’une homogreffe ou d’une xénogreffe en position pulmonaire), mais peu disponibles et moins utilisées (cf. fig. 10.3).
• Les bioprothèses sont le plus souvent montées sur une armature de métal et donc relativement encombrantes.
• Plus rarement, il s’agit de prothèses sans armature ou stentless. Les valves stentless permettent une optimisation des performances hémodynamiques par diminution de l’encombrement, mais n’ont pas apporté d’amélioration de la durabilité et sont rarement implantées de nos jours (cf. fig. 10.4).
• Les bioprothèses ne nécessitent pas d’anticoagulants au-delà du 3e mois postopératoire si le rythme est sinusal.
• Mais leur durabilité est limitée à 10-15 ans en moyenne, avec des dégénérescences parfois plus précoces surtout chez les sujets jeunes, ou en fonction du type de prothèse.
• Le futur développement du TAVI valve-in-valve impose d’anticiper cette perspective lors de tout RVA par bioprothèse. Cette discussion doit faire partie des staffs multidisciplinaires appelés Heart Teams. L’utilisation des prothèses non favorables au valve-in-valve doit être délaissée au profit des prothèses stentées bien visibles et à feuillets internes et courts. Deux prothèses spécifiquement conçues pour un futur valve-in-valve ont été développées par les sociétés Medtronic (Avalus®) et Edwards Lifesciences (Inspiris Resilia®) (cf. fig. 10.2).
Fig. 10.2 ![]() Différents types de prothèses chirurgicales biologiques avec armature (xénogreffe).
Différents types de prothèses chirurgicales biologiques avec armature (xénogreffe).
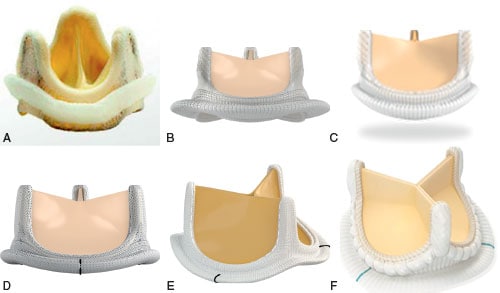
A. Bioprothèse porcine de Carpentier-Edwards® (1965). B. Bioprothèse péricardique Carpentier Edwards® (1980). C. Bioprothèse péricardique Mitroflow® (1985). D. Magna Ease®. E, F. Prothèses de dernière génération : Inspiris® (E) et Avalus® (F).
Figure A : © Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound : a report From the American Society of Echocardiography’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009 ; 22 (9) : 975–1014 ; figures B, C, D, E : © Acknowledgement for use of these images to Edwards Lifesciences LLC, Irvine, CA. Edwards, Edwards Lifesciences, Carpentier-Edwards, Carpentier-Edwards PERIMOUNT, Magna, Magna Ease, Magna Mitral Ease, INSPIRIS, INSPIRIS RESILIA, Edwards SAPIEN, SAPIEN, SAPIEN XT and SAPIEN 3 are trademarks of Edwards Lifesciences Corporation; Figure F : © Pericardial Aortic Surgical Valve, société Medtronic
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
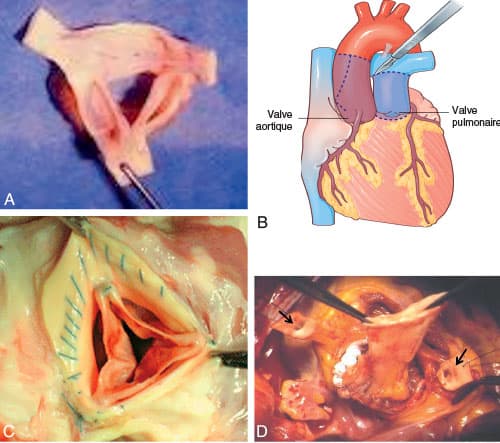
A. Allogreffes/homogreffes (fraîches ou cryopréservées). B. Intervention de Ross. C. Valves en péricarde autologue. D. Allogreffe/homogreffe ou autogreffe implantée à la place du culot aortique natif, nécessitant une réimplantation des artères coronaires (ostia coronaires indiqués par les flèches noires).
Figure B : dessin de Carole Fumat
Fig. 10.4 ![]() Différents types de prothèses chirurgicales biologiques sans armature (bioprothèses stentless).
Différents types de prothèses chirurgicales biologiques sans armature (bioprothèses stentless).
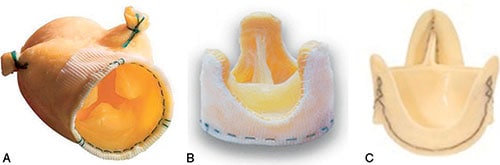
A, B. Bioprothèses porcines Freestyle Medtronic® (A) et Toronto® SPV St-Jude (B). C. Bioprothèse péricardique Freedom Solo® (Sorin).
Figure A : © Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound : a report From the American Society of Echocardiography’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009 ; 22 (9) : 975–1014. Figures B et C : © Bernardi FLM, Dvir D, Rodes-Cabau J, Ribeiro HB. Valve-in-Valve Challenges: How to Avoid Coronary Obstruction. Front Cardiovasc Med. 2019 ; 6 : 120.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
2 Bioprothèses percutanées (cf. fig. 10.5)
• Les bioprothèses d’origine animale sont utilisées depuis quelques années pour le remplacement valvulaire aortique percutané (TAVI ou TAVR), destiné aux patients ayant un rétrécissement aortique serré contre-indiqués à la chirurgie ou à haut risque chirurgical, ou même à risque chirurgical intermédiaire.
• Elles sont montées sur des armatures métalliques particulières (inspirées des stents coronariens ou vasculaires) qui permettent leur fixation sur l’anneau aortique calcifié par cathétérisme rétrograde sous anesthésie locale.
• Elles peuvent être déployées par ballon (Sapien 3®) ou autodéployées (Evolut R® et Evolut Pro®, recapturables et repositionnables).
• Elles ne nécessitent pas d’anticoagulation efficace, les patients sont placés sous simple antiagrégation plaquettaire au long cours (aspirine faible dose, recommandations ESC 2021). En cas d’indication à une anticoagulation efficace (fibrillation atriale [FA], maladie thromboembolique), une anticoagulation efficace par AVK ou AOD (anticoagulants oraux directs) seule peut être poursuivie au long cours.
• Plus rarement, elles sont implantées pour remplacer la valve pulmonaire dans certaines cardiopathies congénitales.
• Comme pour toute bioprothèse, un risque de dégénérescence existe et, étant plus récentes, leur durabilité reste à définir. (Très peu documentée au-delà de 5 ans, même si le suivi échocardiographique des registres ne rapporte pas de signal de détérioration précoce à 5 ans).
• Enfin le TAVI valve-in-valve est entré dans la pratique courante. Du fait des projections démographiques et de l’utilisation croissante des bioprothèses aortiques, il sera amené à se développer : il permet d’éviter des chirurgies redux à haut risque avec de bons résultats.
Fig. 10.5 ![]() Prothèses valvulaires aortiques percutanées (= endoprothèses) biologiques stentées (TAVI ou TAVR).
Prothèses valvulaires aortiques percutanées (= endoprothèses) biologiques stentées (TAVI ou TAVR).

A. Edwards Sapiens®. B. Sapiens3®. C. Prothèse déployée au ballon. D. Corevalve®. E. Evolut R®. F. Prothèse autodéployée.
Figure A : © Zoghbi WA, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, Grayburn PA, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound : a report From the American Society of Echocardiography’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2009 ; 22 (9) : 975–1014. Elsevier Masson SAS. Figure B : © Transcatheter Aortic Valve Replacement (TAVI), société Edwards. Acknowledgement for use of these images to Edwards Lifesciences LLC, Irvine, CA. Edwards, Edwards Lifesciences, Carpentier-Edwards, Carpentier-Edwards PERIMOUNT, Magna, Magna Ease, Magna Mitral Ease, INSPIRIS, INSPIRIS RESILIA, Edwards SAPIEN, SAPIEN, SAPIEN XT and SAPIEN 3 are trademarks of Edwards Lifesciences Corporation. Figure C : © Transcatheter Aortic Valve Replacement (TAVI), société Medtronic Tous droits réservés.Figure D : © Popma JJ, Reardon MJ, Khabbaz K, Harrison JK, Hughes GC, Kodali S, et al. Early Clinical Outcomes After Transcatheter Aortic Valve Replacement Using a Novel Self-Expanding Bioprosthesis in Patients With Severe Aortic Stenosis Who Are Suboptimal for Surgery : Results of the Evolut R U.S. Study. JACC Cardiovasc Interv. 2017 ; 10 (3) : 268–75. ELsevier Masson SAS. Tous droits réservés.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
C Choix du type de prothèse (cf. fig. 10.6 et tableau 10.1)
• Les prothèses mécaniques exposent au risque thromboembolique mais également hémorragique du fait du traitement anticoagulant.
• Les prothèses biologiques exposent au risque de dégénérescence et donc de réintervention.
• La sélection se fait donc selon :
– le choix éclairé du patient, son espérance de vie et son mode de vie ;
– la balance risque thromboembolique/risque hémorragique ;
– le risque de dégénérescence structurelle.
• Les prothèses mécaniques sont généralement préférées chez les sujets d’âge < 60 ans pour les prothèses aortiques ou < 65 ans pour les prothèses mitrales. • Les prothèses biologiques sont généralement indiquées chez les sujets d’âge > 65 ans pour les prothèses aortiques ou > 70 ans pour les prothèses mitrales (dont la durabilité est moindre).
• Les prothèses percutanées sont réservées aux patients ayant une contre-indication ou un très haut risque chirurgical, ou même un risque chirurgical intermédiaire. Cela concerne globalement les patients âgés (> 75 ans), ou présentant des comorbidités, ou fragiles selon une évaluation multidisciplinaire (Heart Team incluant cardiologues, chirurgiens cardiaques, anesthésistes-réanimateurs, gériatres).
• Après 75 ans, il existe un consensus pour envisager le TAVI en 1re intention si l’anatomie est favorable (recommandations ESC 2021).
Fig. 10.6 ![]() Algorithme décisionnel pour le choix d’une prothèse.
Algorithme décisionnel pour le choix d’une prothèse.
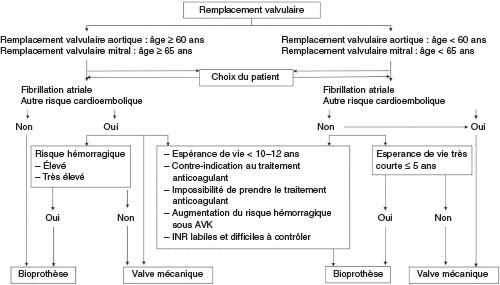
AVK : antivitamine K ; INR : International Normalized Ratio.
Adapté d’après Rahimtoola SH. Choice of prosthetic heart valve in adults an update. J Am Coll Cardiol. 2010 ; 55 (22) : 2413–26. © 2010 Elsevier Masson SAS. Tous droits réservés.
Tableau 10.1 ![]() Synthèse des caractéristiques des différents types de prothèses valvulaires.
Synthèse des caractéristiques des différents types de prothèses valvulaires.
| Prothèse mécanique | Bioprothèse | |
|---|---|---|
| Indications | • Choix du patient • Absence de contre-indication aux AVK • Risque de dégénérescence précoce (hyperparathyroïdie, IRnC) • Autres indications d’AVK (FA, MTE) • Patient jeune avec espérance de vie raisonnable : – < 60 ans en position aortique – < 65 ans en position mitrale • Éducation thérapeutique possible • Souhait d’une intervention définitive : haut risque chirurgical si réintervention |
• Choix du patient • Risque de complication (compliance) ou contre-indication aux AVK (risque hémorragique, comorbidités, conduites à risque) • ATCD de thrombose de prothèse mécanique malgré INR efficace • Désir de grossesse • Faible risque de réintervention • Patient âgé ou avec espérance de vie prévisible inférieure à la celle de la bioprothèse : – 65 ans position aortique – 70 ans en position mitrale |
| Avantages | Durée prolongée (> 15 ans en l’absence de complication) | Pas d’anticoagulation à vie |
| Inconvénients complications | • Anticoagulation à vie avec risque de thrombose de prothèse (si sous-dosage) ou de saignement (si surdosage) • Endocardite infectieuse • Désinsertion, hémolyse • Bruits de valve perçus |
• Durée courte : 10–15 ans avec dégénérescence de bioprothèse • Endocardite infectieuse • Désinsertion • Thrombose |
| Suivi au long cours | • Anticoagulation a vie selon INR cible, éducation, auto-INR • Suivi cardiologique annuel • Prévention de l’endocardite infectieuse dont soins dentaires biannuels avec antibioprophylaxie • Port d’une carte |
• Anticoagulation 3 mois postopératoires selon recommandations • Suivi cardiologique annuel • Prévention de l’endocardite infectieuse dont soins dentaires biannuels avec antibioprophylaxie • Port d’une carte |
ATCD : antécédent ; AVK : antivitamine K ; FA : fibrillation atriale ; IRN : International Normalized Ratio ; IRnC : insuffisance rénale chronique ; MTE : maladie thromboembolique.
II Physiopathologie
• Les prothèses valvulaires fonctionnent comme des valves natives : le jeu de l’élément mobile (bille autrefois, disque basculant ou double ailette de nos jours, cusps des valves biologiques) se fait sous l’effet des variations de pression dans les cavités cardiaques en amont et en aval de la prothèse ; il permet le passage du sang dans le sens de la circulation et empêche le reflux ou régurgitation en sens inverse.
• Les valves mécaniques comportent un risque de thrombose nécessitant une anticoagulation efficace par AVK.
• Les valves biologiques présentent un risque de dégénérescence avec développement de calcifications conduisant à une sténose, ou exposant à risque de déchirure, en particulier commissural.
III Complications des valves cardiaques
A Complications thromboemboliques
• Ce sont les complications les plus fréquentes des prothèses valvulaires.
• Elles sont beaucoup plus fréquentes avec les prothèses mécaniques qu’avec les prothèses biologiques, d’où la nécessité absolue d’un traitement anticoagulant par antivitamine K à vie et parfaitement équilibré pour les porteurs de valves mécaniques.
• Elles prédominent dans la 1re année suivant l’intervention, avant l’endothélialisation de la collerette de la prothèse, mais le risque persiste au-delà
• Le risque est plus élevé :
– pour les prothèses mitrales (qui fonctionnent à faibles pressions) que pour les prothèses aortiques ;
– pour les prothèses anciennes (à billes en particulier) que pour les prothèses à double ailette ;
– en cas de FA, ou de dysfonction ventriculaire gauche.
• Le principal facteur de risque est un traitement anticoagulant insuffisant.
1 Embolies systémiques
• Elles sont dues à la migration d’un thrombus à partir de la prothèse.
• Elles sont le plus souvent cérébrales (70 % des cas, accident ischémique transitoire ou accident vasculaire cérébral constitué, avec parfois séquelles définitives).
• Plus rarement, il s’agit d’ischémie aiguë d’un membre, d’infarctus du myocarde par embolie coronarienne, d’infarctus rénal ou splénique, etc.
• L’embole peut être secondaire à une thrombose obstructive ou non obstructive.
• Les thromboses non obstructives n’empêchent pas le mouvement de l’élément mobile de la prothèse, et surviennent surtout sur les prothèses mitrales, avec thrombus sur la face atriale de la prothèse en échographie transœsophagienne (ETO).
2 Thromboses obstructives de prothèse mécanique
• Les mouvements de l’élément mobile de la prothèse sont diminués en cas de thrombose obstructive (cf. fig. 10.7 et vidéos 10.3).
• Elles sont à l’origine d’accidents brutaux, avec œdème aigu pulmonaire, ou syncope, ou état de choc, voire mort subite ou très rapide.
• Le diagnostic de thrombose de prothèse est souvent difficile : il existe des modifications de l’auscultation (diminution de l’amplitude des bruits de prothèse, apparition ou renforcement d’un souffle systolique pour une prothèse aortique ou d’un roulement diastolique pour une prothèse mitrale). Un traitement anticoagulant insuffisant est souvent en cause, il convient de vérifier l’INR (International Normalized Ratio) en urgence et d’adapter l’anticoagulation.
• Le diagnostic est fait par :
– le radiocinéma de prothèse, sous amplificateur de brillance, qui peut montrer une diminution du jeu des éléments mobiles radio-opaques ;
– l’ETT et l’ETO :
- les gradients transprothétiques sont anormalement élevés, la surface valvulaire fonctionnelle est réduite,
- il peut exister une fuite intraprothétique par fermeture incomplète de la prothèse,
- enfin, le thrombus est parfois visible en ETT/ETO ou en scanner
• La prise en charge comporte :
– l’hospitalisation pour réintervention d’urgence pour changement de valve en cas de thrombose aiguë de prothèse (mortalité de 30 %) ;
– en cas de contre-indication à la chirurgie ou dans les formes subaiguës résistantes au traitement anticoagulant, la thrombolyse, avec parfois de bons résultats ;
– en cas de dysfonction de prothèse de moindre gravité, la rééquilibration du traitement anticoagulant avec passage transitoire à l’héparine si nécessaire ou adjonction d’antiagrégant plaquettaire.
• Le diagnostic différentiel (ou l’association) avec l’endocardite infectieuse est parfois difficile, d’autant qu’une fébricule est possible dans les thromboses de prothèse.
Fig. 10.7 ![]() Thrombose obstructive de prothèse mécanique en position mitrale.
Thrombose obstructive de prothèse mécanique en position mitrale.
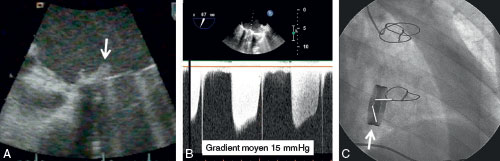
A. Thrombus sur le versant atrial de la prothèse en échographie transœsophagienne (flèche). B. Élévation du gradient moyen transmitral à 15 mmHg (normalement < 6 mmHg). C. Blocage d’une ailette (surlignée en blanc) en radiocinéma (flèche).
3 Thromboses de prothèse biologique (cf. fig. 10.8)
• Des cas de thrombose de valves biologiques, précoces ou tardives, ont été décrits en particulier sur les prothèses percutanées (13 %) mais également sur les prothèses chirurgicales (3 %).
• Le diagnostic est généralement suspecté en ETT par une élévation brutale des gradients sans anomalie structurelle évidente des cusps (notamment pas de calcification) et confirmé en ETO (image d’addition hypo ou isoéchogène) et en scanner (image hypodense).
• Le traitement repose sur une anticoagulation efficace par AVK en 1re intention.
Fig. 10.8 ![]() Thrombose obstructive d’endoprothèse percutanée de type Corevalve®.
Thrombose obstructive d’endoprothèse percutanée de type Corevalve®.
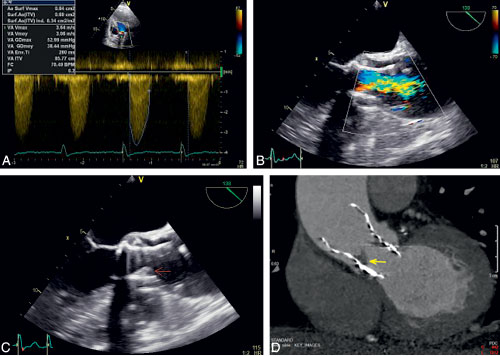
A. Élévation des gradients en doppler. B. Aliasing en doppler couleur en échographie transœsophagienne (ETO). C. Image d’épaississement de cusps (flèche) en ETO. D. Aspect de thrombus au scanner (flèche).
B Complications infectieuses
1 Médiastinite postopératoire
![]() Elle survient dans 1 % des cas environ. C’est une cause de mortalité précoce de la chirurgie cardiaque, en particulier coronarienne, avec un taux de décès de l’ordre de 20 % des patients atteints. Elle est liée à la contamination par les germes du patient, des soignants ou de l’environnement du fait de la sternotomie. Les germes le plus souvent en cause sont les staphylocoques dorés ou blancs.
Elle survient dans 1 % des cas environ. C’est une cause de mortalité précoce de la chirurgie cardiaque, en particulier coronarienne, avec un taux de décès de l’ordre de 20 % des patients atteints. Elle est liée à la contamination par les germes du patient, des soignants ou de l’environnement du fait de la sternotomie. Les germes le plus souvent en cause sont les staphylocoques dorés ou blancs.
2 Endocardite infectieuse (cf. fig. 10.9)
• ![]() C’est une complication redoutable chez les porteurs de prothèse. Ces sujets ont un risque majoré d’endocardite et doivent bénéficier d’une prophylaxie draconienne, et ceci leur vie durant. Il faut insister sur la prévention et le traitement indispensable de tout foyer infectieux, notamment ORL et dentaire, chez les porteurs de prothèses.
C’est une complication redoutable chez les porteurs de prothèse. Ces sujets ont un risque majoré d’endocardite et doivent bénéficier d’une prophylaxie draconienne, et ceci leur vie durant. Il faut insister sur la prévention et le traitement indispensable de tout foyer infectieux, notamment ORL et dentaire, chez les porteurs de prothèses.
• Il existe des formes précoces et des formes tardives d’endocardite sur prothèse, qui comportent un pronostic différent :
– l’endocardite postopératoire précoce est due à une contamination peropératoire par des germes hospitaliers multirésistants, le plus souvent staphylocoques dorés ou blancs. Il s’agit d’EI en général aiguës et qui se compliquent de désinsertion de prothèse. La réintervention précoce est le plus souvent nécessaire. Le pronostic est très sévère (mortalité de l’ordre de 50 %) ;
– l’endocardite tardive est plus proche de l’endocardite sur valve native avec des germes comparables, mais le staphylocoque est néanmoins en cause dans 50 % des cas. Le pronostic est meilleur que celui de l’EI précoce. La réintervention est nécessaire en cas d’atteinte périvalvulaire notamment.
• Le diagnostic de l’EI repose sur les hémocultures pour identifier le germe et l’ETT et l’ETO pour confirmer l’atteinte de l’endocarde : visualisation des végétations sur la prothèse et des éventuelles complications (désinsertion avec fuite paraprothétique, abcès) selon les critères de Duke (cf. encadré 10.1).
Encadré 10.1 ![]() Critères de Duke modifiés pour le diagnostic d’endocardite
Critères de Duke modifiés pour le diagnostic d’endocardite
| Critères majeurs Hémocultures positives en l’absence de foyer infectieux identifié • Bactérie typique de l’EI avec ≥ 2 hémocultures (prélèvements distincts) : staphylocoque, streptocoques viridans et bovis, entérocoques communautaires, HACEK • Bactérie responsable d’EI avec hémocultures persistantes : – 2 hémocultures + sur prélèvements distincts à > 12 heures d’écart – 3 hémocultures ou la majorité des ≥ 4 hémocultures réalisées sur des prélèvements distincts avec > 1 heure entre la 1re et la dernière hémoculture • 1 hémoculture positive ou sérologie positive à Coxiella burnetii Atteinte endocarditique • Lésion échographique – Végétation – Abcès – Fuite paravalvulaire de novo • Fuite valvulaire de novo (et non aggravation ou changement d’un souffle préexistant) • Atteinte de l’endocarde en TEP-scanner (prothèse) ou scannerCritères mineurs • Prédisposition : valvulopathie, prothèse, cardiopathie congénitale cyanogène, ATCD d’EI, toxicomanie IV • Fièvre : température > 38 °C • Manifestations vasculaires : emboles périphériques (pulmonaires, systémiques), anévrisme mycotique, hémorragie intracrânienne, hémorragies conjonctivales, tâches de Janeway • Manifestations immunologiques : nodules d’Osler, taches de Roth, facteur rhumatoïde, glomérulonéphrite • Critères microbiologiques mineurs : hémoculture ne remplissant pas les conditions d’un critère majeur, ou sérologie + d’un germe responsable d’endocardite. Endocardite certaine : 2 critères majeurs ou 1 critère majeur + 3 critères mineurs ou 5 critères mineurs. Endocardite possible : 1 critère majeur + 1 critère mineur ou 3 critères mineurs. ATCD : antécédent ; EI : endocardite infectieuse ; HACEK : Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae ; IV : intraveineux ; TEP : tomographie par émission de positons. Adapté de Li JS, Sexton DJ, Mick N, Nettles R, Fowler VG Jr, Ryan T, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 2000 ; 30 (4) : 633–8. |
• L’imagerie de coupe et le TEP-scanner (tomographie à émission de positons couplée au scanner) ont une place importante dans l’aide au diagnostic d’EI sur prothèse qui est parfois difficile, et le bilan d’extension de la maladie infectieuse (emboles). Le TEP scanner peut mettre en évidence des zones de fixation intense autour de la prothèse et au niveau des emboles du fait d’un hypermétabolisme local. Le TEP-scanner n’est pas interprétable pendant les 3 mois qui suivent la chirurgie valvulaire.
• En cas de fièvre inexpliquée chez un patient porteur de prothèse valvulaire, il est indispensable de réaliser des hémocultures systématiques, avant toute antibiothérapie prescrite à l’aveugle, et une échocardiographie en fonction du contexte clinique et du résultat des hémocultures.
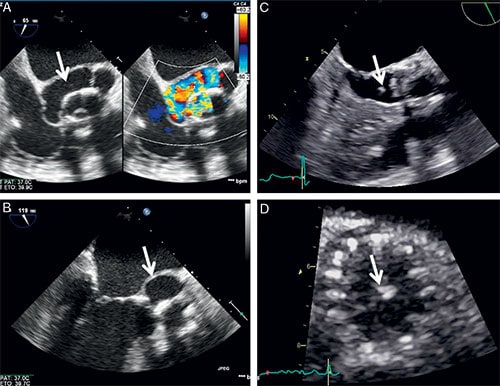
A et B. Volumineux abcès détergé (flèches) de la zone aorto-mitral (trigone) sur une bioprothèse de type Carpentier-Edwards®. C. Végétation visible dans la chambre de chasse aortique développée sur une bioprothèse percutanée Edwards Sapien®. D. Petite végétation centrale sur une bioprothèse percutanée CoreValve®.
C Complications du traitement anticoagulant (cf. item 330 – chapitre 22)
• ![]() Le risque hémorragique des anticoagulants est estimé à 1,2 % par an (1,2 % années-patients) pour les porteurs de valves mécaniques.
Le risque hémorragique des anticoagulants est estimé à 1,2 % par an (1,2 % années-patients) pour les porteurs de valves mécaniques.
• Les complications hémorragiques sont de tout type : hémorragie cérébrale, digestive ou hématurie qui doivent faire rechercher une lésion organique sous-jacente, ménométrorragies, hématome favorisé par un traumatisme. Leur gravité est variable, mais certaines peuvent aboutir au décès.
• En cas d’hémorragie sévère, le traitement par antivitamine K doit être interrompu, mais le maintien d’une anticoagulation par l’héparine est indispensable, en maintenant un TCA (temps de céphaline activée) à 1,5–2 fois le témoin si l’on utilise l’héparine non fractionnée. L’interruption très temporaire du traitement anticoagulant est parfois nécessaire, lorsque le risque hémorragique menace le pronostic vital notamment en cas d’hémorragie intracrânienne.
D Détérioration structurelle des prothèses
1 Dégénérescence des bioprothèses (cf. fig. 10.10)
• ![]() La détérioration tissulaire des bioprothèses est inexorable avec les années.
La détérioration tissulaire des bioprothèses est inexorable avec les années.
• Elle est définie par l’altération non infectieuse des feuillets valvulaires avec apparition de calcifications ou de déchirure, responsables de sténose et/ou de fuites valvulaires imposant une réintervention.
• La dégénérescence de bioprothèse survient en général au bout de 5 à 15 ans en fonction du type de substitut, du site d’implantation (mitral > aortique), et de l’âge du patient (jeune > personne âgée).
• ![]() La physiopathologie reste mal connue, plusieurs mécanismes semblent en cause :
La physiopathologie reste mal connue, plusieurs mécanismes semblent en cause :
– un mécanisme de dégénérescence passive avec accumulation de cristaux phosphocalciques. Un traitement préalable de la valve par un produit anticalcique permet de réduire la survenue des calcifications ;
– un mécanisme proche de l’athérosclérose ;
– un mécanisme immunologique de rejet cellulaire malgré un prétraitement des tissus par le glutaraldéhyde ;
– enfin les complications locales (thrombose, endocardite) traitées médicalement pourraient également accélérer le processus de dégénérescence.
• ![]() Le diagnostic est évoqué devant :
Le diagnostic est évoqué devant :
– l’apparition ou la modification d’un souffle ;
– la réapparition de symptômes d’effort ;
– la mise en évidence, lors d’un contrôle échocardiographique, de calcifications des cusps, d’une prothèse sténosante ou fuyante en échodoppler ;
– des signes d’insuffisance cardiaque lorsque la sténose ou fuite est importante.
• Le diagnostic est fait par l’ETT.
• En cas de dégénérescence sévère et symptomatique, le pronostic vital peut être engagé et une réintervention peut s’avérer nécessaire. Celle-ci est souvent à risque compte tenu du caractère généralement âgé des patients, de leurs comorbidités et du fait qu’il s’agit d’une intervention redux. Le développement des techniques de remplacement valvulaire par voie percutanée (valve-in-valve) vient contrebalancer cette situation et ouvre de nouvelles perspectives thérapeutiques.
Fig. 10.10 ![]() Dégénérescence structurelle calcifiée de bioprothèse aortique.
Dégénérescence structurelle calcifiée de bioprothèse aortique.
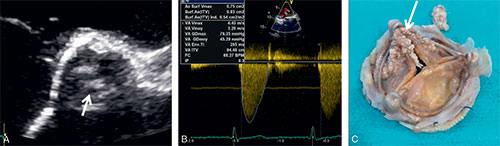
A. Calcifications des cusps (flèche) en échocardiographie. B. Élévation des gradients transprothétiques en doppler. C. Aspect macroscopique de la bioprothèse après explantation avec importantes calcifications (flèche).
2 Détérioration structurelle des prothèses mécaniques
![]() Il s’agit de fracture d’ailette, phénomène assez rare.
Il s’agit de fracture d’ailette, phénomène assez rare.
E Dysfonction non structurelle de prothèse
1 Désinsertions de prothèse (cf. fig. 10.11 et vidéo 10.5)
• ![]() Elles surviennent dans 5 % des cas ; surtout durant les premiers mois postopératoires, et sont à l’origine d’une fuite paraprothétique.
Elles surviennent dans 5 % des cas ; surtout durant les premiers mois postopératoires, et sont à l’origine d’une fuite paraprothétique.
• Elles sont soit :
– spontanées, par lâchage de sutures sur des tissus fragilisés par des interventions multiples ou des calcifications annulaires,
– dues à une EI, qu’il faut toujours évoquer et rechercher dans cette situation.
• Le diagnostic est évoqué devant :
– l’apparition d’un souffle, diastolique pour une prothèse aortique, systolique pour une prothèse mitrale ;
– la mise en évidence, lors d’un contrôle échocardiographique, d’une élévation des gradients transprothétiques et d’un flux de régurgitation anormal le plus souvent en doppler couleur ;
– l’apparition d’une anémie hémolytique plus ou moins sévère caractérisée par :
- élévation des LDH (lactate-déshydrogénases),
- baisse de l’haptoglobine,
- présence de schizocytes, hématies fragmentées qui signent le caractère mécanique de l’hémolyse ;
– des signes d’insuffisance cardiaque lorsque la désinsertion est importante.
• Le diagnostic est fait par l’ETT et surtout par l’ETO : fuite paraprothétique ± importante.
• En cas de désinsertion importante, symptomatique, une réintervention peut s’avérer nécessaire par chirurgie conventionnelle ou bien par voie percutanée.
Fig. 10.11 ![]() Désinsertion de prothèse biologique en position mitrale, avec une fuite mitrale sévère.
Désinsertion de prothèse biologique en position mitrale, avec une fuite mitrale sévère.
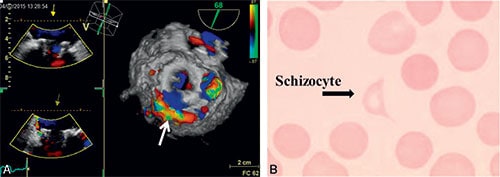
A. Échographie transœsophagienne 3D vue de face : fuite mitrale sévère périprothétique, jet principal postéroexterne (flèche). B. Schizocyte (hématie fragmentée) témoin d’une hémolyse intravasculaire.
2 Pannus fibreux
• ![]() Il s’agit de tissu conjonctif se développant sur le versant atrial des prothèses mitrales ou ventriculaire des prothèses aortiques et qui peut créer une sténose orificielle extravalvulaire (cf. fig. 10.12).
Il s’agit de tissu conjonctif se développant sur le versant atrial des prothèses mitrales ou ventriculaire des prothèses aortiques et qui peut créer une sténose orificielle extravalvulaire (cf. fig. 10.12).
• Il n’existe pas de traitement préventif et la sanction est chirurgicale en cas de symptômes.
Fig. 10.12 ![]() Dysfonction sténosante par pannus (flèche) s’étendant dans une prothèse mécanique (A) ou sur bioprothèse (B).
Dysfonction sténosante par pannus (flèche) s’étendant dans une prothèse mécanique (A) ou sur bioprothèse (B).
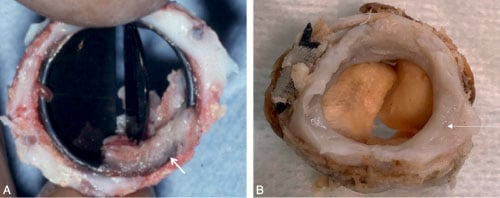
3 Mismatch ou disproportion patient/prothèse
Lorsque la surface valvulaire effective d’une prothèse implantée est trop petite par rapport à la surface corporelle du patient, il y a une inadéquation entre la surface valvulaire et le débit cardiaque adapté aux besoins du patient.
IV Surveillance des porteurs de valve cardiaque
A En postopératoire immédiat
• ![]() Un relais par AVK est entrepris précocement, dès les premiers jours postopératoires ; il doit être maintenu à vie en cas de prothèse mécanique (cf. tableau 10.2), 3 mois en cas de bioprothèse si le rythme est sinusal (cf. tableau 10.3).
Un relais par AVK est entrepris précocement, dès les premiers jours postopératoires ; il doit être maintenu à vie en cas de prothèse mécanique (cf. tableau 10.2), 3 mois en cas de bioprothèse si le rythme est sinusal (cf. tableau 10.3).
• Les bioprothèses aortiques en rythme sinusal peuvent être soit anticoagulées par AVK, soit recevoir un simple traitement antiagrégant pendant au moins 3 mois.
• En cas de FA, un traitement par AOD peut être envisagé dès le postopératoire en cas de bioprothèse mitrale.
• Vers le 8e jour postopératoire, un séjour de convalescence en centre de réadaptation fonctionnelle cardiorespiratoire est le plus souvent entrepris, et dure 3 à 4 semaines.
• L’ETT précoce de la prothèse est essentielle, car elle sert d’examen de référence pour le suivi ultérieur. Il est recommandé de considérer l’ETT faite au 3e mois postopératoire comme l’examen de référence (après correction de l’anémie et de la tachycardie postopératoires, qui augmentent le débit cardiaque).
Tableau 10.2 ![]() INR cible pour les valves mécaniques.
INR cible pour les valves mécaniques.
| Risque thrombotique de la prothèse | Facteurs de risque1 liés au patient | |
| 0 | ≥ 1 | |
| Faible | 2,5 | 3,0 |
| Moyen | 3,0 | 3,5 |
| Élevé | 3,5 | 4,0 |
1Prothèse en position mitrale, tricuspide ou pulmonaire, antécédent thromboembolique, fibrillation atriale, sténose mitrale (quelle que soit la sévérité), fraction d’éjection < 35 %.
© Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. ; ESC/EACTS Scientific Document Group ; ESC Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022 ; 43 (7) : 561–632.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
Tableau 10.3 ![]() Anticoagulation pour les bioprothèses.
Anticoagulation pour les bioprothèses.
| Prothèse | Anticoagulation/AAP | AOD |
|---|---|---|
| Bioprothèse aortique | Aspirine ou AVK 3 mois puis rien | Autorisé > 3 mois si indication non valvulaire |
| Bioprothèse mitrale | AVK 3 mois puis rien | Toléré dès le postopératoire si FA Autorisé > 3 mois et indication non valvulaire |
| Bioprothèse tricuspide, plastie mitrale | AVK 3 mois puis rien | Autorisé > 3 mois et indication non valvulaire |
| Endoprothèse aortique (TAVI) | Aspirine seule au long cours si rythme sinusal Anticoagulation si FA |
Autorisé si indication FA |
AAP : antiagrégant plaquettaire ; AOD : anticoagulant oral direct ; AVK : antivitamine K ; FA : fibrillation atriale ; TAVI : Transcatheter Aortic Valve Implantation.
D’après Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. ; ESC/EACTS Scientific Document Group ; ESC Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022 ; 43 (7) : 561–632.
B Surveillance ultérieure (cf. fig. 10.13)
1 Modalités
• Le suivi est réalisé à 1 mois, puis tous les 3 mois par le médecin traitant, afin de vérifier notamment l’état clinique et l’équilibre du traitement anticoagulant par les AVK.
• La consultation du cardiologue a lieu au 2–3e mois postopératoire, à la fin de la convalescence, notamment pour la réalisation de l’ETT de référence. Le patient est ensuite suivi par le cardiologue 1 à 2 fois/an.
• Le porteur de valve cardiaque doit être muni :
– d’une carte de porteur de prothèse qui lui est remise à la sortie du service de chirurgie cardiaque, précisant le type, le diamètre et le numéro de série de la prothèse ;
– d’un carnet de surveillance du traitement anticoagulant précisant l’INR cible pour les prothèses mécaniques ;
– d’une carte d’antibioprophylaxie pour son dentiste, car il est à haut risque d’endocardite. Tout geste dentaire à risque infectieux, y compris le détartrage, doit être réalisé sous antibiothérapie ponctuelle. Le suivi dentaire doit être au moins biannuel.
Fig. 10.13 ![]() Surveillance au long cours des patients porteurs de prothèses de valve cardiaque.
Surveillance au long cours des patients porteurs de prothèses de valve cardiaque.
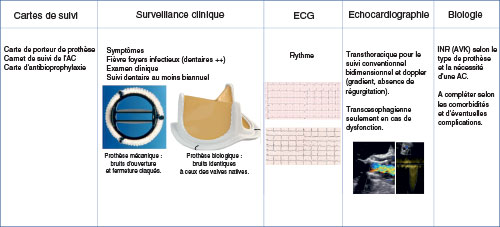
2 Surveillance clinique
• Il faut vérifier l’absence de réapparition des symptômes ayant justifié le remplacement valvulaire. La réapparition d’une dyspnée ou une récidive d’insuffisance cardiaque doit faire suspecter une dysfonction de prothèse et nécessite une réhospitalisation.
• L’auscultation de la prothèse est essentielle pour la surveillance :
– les bioprothèses ont à l’auscultation des bruits du cœur identiques à ceux des valves natives, avec un petit souffle éjectionnel systolique aortique pour les bioprothèses en position aortique ;
– les prothèses mécaniques ont une auscultation très particulière. Les bruits d’ouverture et surtout de fermeture sont intenses, claqués, métalliques. Les prothèses récentes, à double ailette, sont moins bruyantes que les prothèses valvulaires d’ancienne génération ;
– les modifications pathologiques sont la diminution d’intensité ou le caractère variable des bruits d’ouverture ou de fermeture d’un cycle cardiaque à l’autre (en l’absence de FA), l’apparition ou l’augmentation d’intensité d’un souffle systolique, ou l’apparition d’un bruit diastolique surajouté (souffle d’insuffisance aortique en cas de prothèse aortique ou roulement diastolique en cas de prothèse mitrale).
• L’absence de fièvre ou de foyer infectieux doit être vérifiée soigneusement à chaque consultation.
• Il faut également s’assurer de l’absence de manifestation ischémique ou hémorragique.
• La régularité du suivi dentaire doit être contrôlée à l’interrogatoire.
3 Surveillance radiologique
• ![]() Le cliché de thorax permet d’apprécier les modifications de volume de la silhouette cardiaque, qui diminue souvent de taille après le remplacement valvulaire. Cet examen n’est plus réalisé en routine en dehors du postopératoire précoce.
Le cliché de thorax permet d’apprécier les modifications de volume de la silhouette cardiaque, qui diminue souvent de taille après le remplacement valvulaire. Cet examen n’est plus réalisé en routine en dehors du postopératoire précoce.
• Le radiocinéma de prothèse peut être intéressant pour apprécier le jeu de l’élément mobile de la prothèse mécanique, mais n’est utilisé qu’en cas de suspicion de dysfonction de prothèse mécanique.
• Le scanner et le TEP-scanner peuvent être utilisés en cas de suspicion de thrombose de prothèse, de pannus ou d’EI.
4 Surveillance ECG
• ![]() L’ECG, réalisé lors de la consultation cardiologique, permet la surveillance du rythme cardiaque. Il peut permettre de constater la régression éventuelle d’une hypertrophie ventriculaire gauche ou droite, de dépister un trouble du rythme supraventriculaire mais il n’apporte pas d’élément spécifique pour la surveillance de la prothèse.
L’ECG, réalisé lors de la consultation cardiologique, permet la surveillance du rythme cardiaque. Il peut permettre de constater la régression éventuelle d’une hypertrophie ventriculaire gauche ou droite, de dépister un trouble du rythme supraventriculaire mais il n’apporte pas d’élément spécifique pour la surveillance de la prothèse.
• En revanche, l’ECG peut dépister un passage en FA qui n’est pas exceptionnel, notamment en cas de prothèse mitrale.
5 Échocardiogramme doppler
• L’ETT doit être réalisé tous les 1 à 2 ans pour les valves mécaniques en l’absence de complication.
• Pour les bioprothèses conventionnelles, après le contrôle à 3 mois et 1 an, l’ETT est réalisée de façon annuelle. Une attention particulière est demandée en cas de prothèses percutanées, de bioprothèses de dernière génération (dont on ignore la durabilité) ou dans les situations à risque de dégénérescence précoce.
• ![]() L’examen bidimensionnel permet d’apprécier le jeu de l’élément mobile.
L’examen bidimensionnel permet d’apprécier le jeu de l’élément mobile.
• L’examen doppler permet de mesurer les gradients transprothétiques, en particulier la vitesse maximale antérograde et le gradient moyen. Couplé à l’examen bidimensionnel, il permet également de déterminer la surface fonctionnelle de la prothèse.
• Le doppler continu et couleur permet également de mettre en évidence une fuite prothétique, intraprothétique ou paraprothétique par désinsertion de la valve.
• Lors du suivi, il faut comparer les résultats d’un examen à l’autre, le patient étant sa propre référence.
• Les gradients les plus faibles sont enregistrés sur les bioprothèses et, pour les prothèses mécaniques, sur les valves à double ailette. Plus la prothèse est petite, plus les gradients ont tendance à augmenter et la surface fonctionnelle à diminuer.
• ![]() L’ETT et l’ETO sont les examens les plus performants pour la surveillance des prothèses valvulaires (ETT) et le diagnostic des dysfonctions de prothèse (ETO).
L’ETT et l’ETO sont les examens les plus performants pour la surveillance des prothèses valvulaires (ETT) et le diagnostic des dysfonctions de prothèse (ETO).
• L’ETO n’est réalisée qu’en cas de suspicion de dysfonction de prothèse. Dans cette situation, elle est d’un apport essentiel, notamment s’il s’agit d’une prothèse mitrale, qui est particulièrement bien visualisée par cette technique. L’ETO est donc systématique en cas de suspicion de thrombose, d’endocardite sur prothèse ou de désinsertion pour confirmer le diagnostic et guider la prise en charge.
6 Surveillance biologique
• Pour les prothèses mécaniques, on doit rechercher un équilibre le plus parfait possible du traitement anticoagulant par les AVK, et ceci à vie. La surveillance du traitement AVK repose sur l’INR.
• L’INR doit être surveillé initialement 1–2 fois/semaine jusqu’à obtention d’un bon équilibre, puis au moins 1 fois/mois au long cours, plus souvent si nécessaire.
• Pour les porteurs de prothèses mécaniques, l’INR cible doit être compris entre 2,5 et 4. Une variation maximale de 0,5 point est tolérable de part et d’autre de l’INR cible (cf. tableau 10.2).
• Le niveau exact d’anticoagulation souhaité pour un patient donné est à discuter avec le cardiologue et établi individuellement, en se fondant sur les recommandations de la Société européenne de cardiologie de 2021. Il tient compte du type de prothèse, de sa position, des facteurs de risque d’embole liés au patient lui-même, mais également des facteurs de risque d’hémorragie (cf. tableau 10.3).
– Risque thrombotique de la prothèse :
- faible : prothèses mécaniques en position aortique : Medtronic Hall® (valve à disque), ATS®, Saint-Jude®, On-X®, Sorin Bicarbon® et Carbomedics® (valves à double ailette) ;
- moyen : valves à double ailette récentes ou pour lesquelles les données de suivi sont insuffisantes ;
- élevé : Björk-Shiley® (monodisque), Starr® (valve à bille).
– Facteurs de risque liés au patient :
- prothèse en position mitrale ou tricuspide ;
- antécédent thromboembolique ;
- FA ;
- sténose mitrale associée ;
- FE < 35 % ;
- hypercoagulabilité en plus pour les recommandations américaines.
• En Europe, l’adjonction d’antiagrégants plaquettaires n’est pas recommandée en dehors de situations spécifiques souvent transitoires (stent récent) ou définitives (thromboembolie sous INR efficace).
• L’éducation thérapeutique du patient est cruciale avec, lorsque cela est possible, recours aux cliniques d’anticoagulants. Les systèmes d’automesure INR (CoaguChek® INRange) par bandelette (et donc d’auto-adaptation) sont remboursés depuis 2017 uniquement pour les porteurs de prothèse mécaniques mais on estime leur mise en place possible chez seulement 50 % des patients (cf. fig. 10.14).
• Les AOD sont contre-indiqués chez les porteurs de valves mécaniques.
• En cas de bioprothèse, les AOD sont autorisés au-delà du 3e mois postopératoire si l’indication n’est pas valvulaire et peuvent être envisagés en postopératoire immédiat en cas de FA et de bioprothèse mitrale.
• Les HBPM n’ont pas l’AMM (autorisation de mise sur le marché) dans cette situation mais sont reconnues comme une alternative acceptable à l’héparine non fractionnée dans les recommandations européennes.
• Les porteurs de bioprothèse ne nécessitent pas de traitement anticoagulant au long cours, sauf s’il existe une indication telle qu’une FA. Au-delà du 3e mois postopératoire, tous les types d’anticoagulants sont autorisés pour les bioprothèses.
Fig. 10.14 ![]() Système CoaguChek® INRange.
Système CoaguChek® INRange.
© Laboratoire Roche
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
7 Situations particulières
Hémorragie
![]() Le traitement anticoagulant ne doit théoriquement jamais être interrompu (en raison du risque de thrombose), sauf en cas d’hémorragie mettant en jeu le pronostic vital immédiat. Dans ce cas, si la neutralisation de l’AVK est nécessaire, on administre du plasma frais de préférence à la vitamine K (0,5 à 2 mg).
Le traitement anticoagulant ne doit théoriquement jamais être interrompu (en raison du risque de thrombose), sauf en cas d’hémorragie mettant en jeu le pronostic vital immédiat. Dans ce cas, si la neutralisation de l’AVK est nécessaire, on administre du plasma frais de préférence à la vitamine K (0,5 à 2 mg).
Chirurgie non cardiaque
• En cas d’extraction dentaire, le patient peut souvent être traité en ambulatoire, avec un INR de 2 à 2,5. De même, les chirurgies à faible risque hémorragique (cataracte) peuvent être réalisées sous AVK.
• En cas de chirurgie extracardiaque, on arrête les AVK pour obtenir un INR < 1,5 et on administre de l’héparine de manière à obtenir un TCA de 2 fois le témoin dès que l’INR chute en dessous de 2 pour les prothèses mécaniques en position aortique ou 2,5 en position mitrale. L’héparine est interrompue de sorte que le TCA soit normal au moment de l’opération et elle est reprise dès que possible en postopératoire.
• Les HBPM sont de plus en plus utilisées et tolérées pour l’anticoagulation des prothèses valvulaires, à condition bien sûr de les utiliser à dose curative et non à dose préventive ; mais seule l’HNF possède une AMM chez les porteurs de prothèse valvulaire en France.
Grossesse
• La mortalité maternelle est estimée à 1–4 % et il existe un taux d’événement sérieux de 40 % chez les femmes enceintes porteuses de valves mécaniques.
• Les complications thromboemboliques sont plus fréquentes sous héparine que sous AVK chez les femmes enceintes, mais les AVK comportent un risque tératogène pour le fœtus (6e–12e semaine d’aménorrhée) surtout si la dose administrée est élevée.
• Les recommandations européennes actuelles vont plutôt dans le sens d’un traitement par AVK pendant toute la durée de la grossesse jusqu’au 3e trimestre, si la dose de warfarine (Coumadine®) est < 5 mg (ou son équivalent pour une autre molécule) mais cette attitude doit être discutée avec la patiente. • L’attitude classique en France consiste à mettre la patiente sous héparine durant le 1er trimestre de la grossesse (arrêt des AVK de la 5e semaine jusqu’à la 12e semaine incluse) et durant les 2 dernières semaines, en maintenant les AVK entre-temps si la dose de warfarine (Coumadine®) est > 5 mg.
Points-clés
| • Le remplacement d’une valve native dysfonctionnante par une prothèse est un geste de chirurgie cardiaque courante. La qualité des prothèses a beaucoup évolué. Les modèles actuels de prothèses mécaniques, à double ailette, sont très performants, et les prothèses biologiques sont également fiables. • Le remplacement valvulaire par une prothèse entraîne généralement une nette amélioration clinique. Les prothèses valvulaires sont néanmoins un substitut imparfait des valves natives. La mortalité périopératoire n’excède pas 1 à 2 % pour un remplacement monovalvulaire chez des patients jeunes en bon état général, mais augmente avec l’âge, le nombre de gestes à effectuer et les comorbidités. • La survie des opérés dépend surtout de la pathologie initiale, de son retentissement cardiaque et des comorbidités, mais également des complications liées aux prothèses. • Le porteur de prothèse valvulaire est exposé en particulier aux complications thromboemboliques et hémorragiques pour les prothèses mécaniques, à la dégénérescence pour les bioprothèses et à l’endocardite infectieuse quel que soit le type de prothèse. • La surveillance des prothèses fait surtout appel à l’échodoppler transthoracique et le diagnostic des dysfonctions à l’imagerie multimodale (échodoppler transthoracique et transœsophagien, scanner, TEP-scanner, radiocinéma de valve). Le diagnostic peut être difficile et l’examen nécessite un échographiste entraîné. • Les patients sont soumis à certaines contraintes telles que l’observance d’un traitement anticoagulant et ceci à vie pour les porteurs de prothèses mécaniques, ainsi qu’à la prophylaxie de l’endocardite infectieuse. • Pour les prothèses mécaniques, la surveillance du traitement anticoagulant et l’obtention d’un équilibre parfait sont indispensables et doivent être l’objectif principal du suivi effectué par le médecin traitant. L’autosurveillance et l’auto-adaptation de l’anticoagulation peuvent permettre d’améliorer la qualité de vie d’environ 50 % des patients. • Les anticoagulants oraux directs sont contre-indiqués chez les porteurs de prothèse valvulaire mécanique et en cas de sténose mitrale. • Au-delà du 3e mois postopératoire, tous les types d’anticoagulants sont autorisés pour les bioprothèses. • La dégénérescence des bioprothèses est inéluctable, survenant le plus souvent 10 à 15 ans après l’implantation et conduit à discuter un nouveau remplacement valvulaire. • Le remplacement valvulaire percutané, en particulier pour une sténose aortique sur valve native, mais également pour une valve biologique dégénérée, est en plein essor, et constitue une alternative importante à la chirurgie cardiaque dans des indications sélectionnées. |
Notions indispensables et inacceptables
Notions indispensables
• Il existe 2 grands types de prothèses valvulaires : les prothèses mécaniques et les prothèses biologiques.
• Parmi les prothèses biologiques (bioprothèses), on distingue les prothèses chirurgicales, implantées lors de la chirurgie, et les prothèses percutanées ou endoprothèses, implantées par cathétérisme interventionnel (TAVI ou TAVR).
• Les prothèses mécaniques sont prévues pour durer toute la vie du patient mais nécessitent un traitement anticoagulant à vie par AVK, et exposent ainsi aux risques thromboemboliques de la prothèse et hémorragiques des AVK. L’INR doit être surveillé régulièrement et l’anticoagulation ajustée si besoin. Les AOD sont contre-indiqués en cas de prothèse valvulaire mécanique.
• Les prothèses biologiques ne nécessitent pas d’anticoagulation par elle-même (sauf en postopératoire précoce) mais dégénèrent inéluctablement en se calcifiant soit sous forme de sténose, soit sous forme de déchirure et fuite, nécessitant une réopération en moyenne 10 ans après implantation.
• Les bioprothèses percutanées sont actuellement réservées aux patients à risque chirurgical modéré à important ou contre-indiqués à la chirurgie, en général âgés.
• Les prothèses, étant par nature des corps étrangers, présentent un risque accru d’endocardite infectieuse par rapport aux valves natives, et justifient une prophylaxie infectieuse soigneuse. Tout événement aigu fébrile chez un patient porteur d’une prothèse valvulaire doit évoquer une endocardite.
• L’échocardiographie transthoracique est l’examen clé de la surveillance des prothèses valvulaires. L’imagerie multimodale (ETO, radiocinéma, scanner, etc.) est l’imagerie de recours en cas de bilan de dysfonction de prothèse.
• Une prothèse valvulaire est un substitut imparfait de la valve native qui nécessite donc un suivi régulier, au minimum annuel, par un cardiologue.
Notions inacceptables
• Prescrire des anticoagulants oraux directs chez des patients porteurs de valve mécanique.
• Prescrire une antibiothérapie à l’aveugle en cas de fièvre chez un patient porteur de prothèse valvulaire.
• Oublier l’éducation thérapeutique du patient porteur de prothèse valvulaire concernant la prévention de l’endocardite infectieuse et le cas échéant de l’anticoagulation efficace.
• Ne pas penser à une endocardite infectieuse en cas de fièvre.
• Ne pas référer à un spécialiste un patient porteur de prothèse valvulaire symptomatique.
• Ne pas référer à un spécialiste un patient porteur de prothèse valvulaire avec un souffle de novo, que le patient soit symptomatique ou non.
• Ne pas référer à un spécialiste un patient porteur de prothèse valvulaire pour son suivi annuel.
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

CARDIOLOGIE PÉDIATRIQUE Mitral annular disjunction distance is associated with adverse outcomes in children and [...]

LA FRANCE À L’HONNEUR Aspirin in Patients with Chronic Coronary Syndrome Receiving Oral Anticoagulation [...]


