Suivez-nous sur les réseaux sociaux !
Dernières publications
Publications
Chapitre 14 – Item 236 : Troubles de la conduction intracardiaque
I. Définitions
II. Dysfonction sinusale (DS)
III. Blocs atrioventriculaires
IV. Blocs de branche
V. Thérapeutique et suivi du patient
Situations de départ
18 Découverte d’anomalies à l’auscultation cardiaque.
21 Asthénie.
27 Chute de la personne âgée.
28 Coma et troubles de conscience.
38 État de mort apparente.
43 Découverte d’une hypotension artérielle.
50 Malaise/perte de connaissance.
64 Vertige et sensation vertigineuse.
159 Bradycardie.
161 Douleur thoracique.
162 Dyspnée.
178 Demande/prescription raisonnée et choix d’un examen diagnostique.
185 Réalisation et interprétation d’un électrocardiogramme (ECG) .
201 Dyskaliémie.
204 Élévation des enzymes cardiaques.
285 Consultation de suivi et éducation thérapeutique d’un patient avec un antécédent cardiovasculaire.
327 Annonce d’un diagnostic de maladie grave au patient et/ou à sa famille.
328 Annonce d’une maladie chronique.
334 Demande de traitement et investigation inappropriés.
352 Expliquer un traitement au patient (adulte/enfant/adolescent) .
355 Organisation de la sortie d’hospitalisation.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé | Descriptif |
|---|---|---|---|
| Physiopathologie | Connaître la physiopathologie de la dysfonction sinusale, du BAV, du bloc de branche | Anatomie, vascularisation, caractéristiques tissulaires | |
| Diagnostic positif | Savoir évoquer le diagnostic de dysfonction sinusale ou de trouble de conduction | Symptômes, contextes et formes cliniques usuelles | |
| Étiologies | Connaître les principales étiologies des troubles de conduction | Ionique, médicaments, infarctus, dégénératif, valvulopathies | |
| Examens complémentaires | Connaître les examens de 1re intention en cas de dysfonction sinusale ou de trouble de conduction | Enquête étiologique | |
| Identifier une urgence | Connaître les signes et situations de mauvaise tolérance d’une bradycardie | Sémiologie des bradycardies mal tolérées, hyperkaliémies, syndromes coronariens | |
| Prise en charge | Connaître les médicaments tachycardisants et le traitement de l’urgence | Utilisation de l’atropine, de l’isoprénaline et de la stimulation cardiaque temporaire | |
| Prise en charge | Connaître les grandes indications de stimulateur cardiaque définitif dans les troubles de conduction | Indications dans la dysfonction sinusale les BAV et les blocs de branche |
I Définitions
A Rappel anatomique
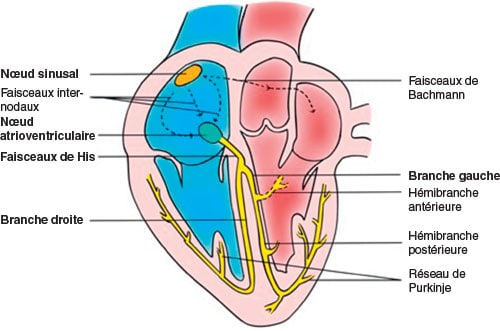
![]() Les voies de conduction sont séparées en trois étages (cf. fig. 14.1).
Les voies de conduction sont séparées en trois étages (cf. fig. 14.1).
Fig. 14.1 ![]() Organisation schématique des voies de conduction intracardiaques.
Organisation schématique des voies de conduction intracardiaques.
B Sur le plan physiopathologique
• La pathologie qui touche au fonctionnement du nœud sinusal (NS) s’appelle la dysfonction sinusale qui comprend les troubles de l’automatisme sinusal et le bloc sinoatrial.
• Le bloc atrioventriculaire (BAV) est défini par une atteinte de la jonction atrioventriculaire et/ou une atteinte bilatérale des branches de division du faisceau de His.
• L’atteinte systématisée d’une ou des branches du faisceau de His entraîne des blocs de branche ou des hémiblocs.
• La conduction intraventriculaire n’est pas l’exclusivité du réseau de Purkinje, elle se fait au sein du myocarde ventriculaire (y compris septal) de proche en proche, mais lentement, ce qui peut conduire à un allongement de la durée du complexe QRS en cas de pathologie myocardique entraînant des blocs intraventriculaires non systématisés.
• ![]() On oppose le tissu nodal qui constitue le nœud sinusal et le nœud atrioventriculaire (NAV) au tissu de type « His Purkinje » qui compose le faisceau de His, les branches du faisceau de His et le réseau de Purkinje. La conduction dans le NAV est lente et décrémentielle comparée à la conduction au sein du « His-Purkinje » où la conduction est rapide et répond à la loi du « tout ou rien ». Le nœud sinusal et le NAV sont fortement influencés par le système nerveux autonome, contrairement au tissu « His-Purkinje ».
On oppose le tissu nodal qui constitue le nœud sinusal et le nœud atrioventriculaire (NAV) au tissu de type « His Purkinje » qui compose le faisceau de His, les branches du faisceau de His et le réseau de Purkinje. La conduction dans le NAV est lente et décrémentielle comparée à la conduction au sein du « His-Purkinje » où la conduction est rapide et répond à la loi du « tout ou rien ». Le nœud sinusal et le NAV sont fortement influencés par le système nerveux autonome, contrairement au tissu « His-Purkinje ».
• ![]() Dans les BAV, il faut séparer l’atteinte nodale (suprahissienne) de l’atteinte du faisceau de His et au-delà (hissienne ou infrahissienne) pour des raisons de gravité.
Dans les BAV, il faut séparer l’atteinte nodale (suprahissienne) de l’atteinte du faisceau de His et au-delà (hissienne ou infrahissienne) pour des raisons de gravité.
• ![]() À noter la hiérarchie décroissante des fréquences d’échappement des différentes structures :
À noter la hiérarchie décroissante des fréquences d’échappement des différentes structures :
– 40–60 bpm à QRS fins stable pour le NAV ;
– 35–45 bpm à QRS fins instable pour le faisceau de His ;
– < 40 bpm à QRS larges instable pour les branches et les ventricules (infrahissiens).
| Il faut ainsi bien différencier en termes de gravité les troubles conductifs suprahissiens (dysfonction sinusale et bloc nodal) ayant un rythme d’échappement plus stable et de fréquence plus élevée des troubles conductifs hissiens ou infrahissiens ayant un rythme d’échappement instable de fréquence plus basse. |
• Au sein de l’oreillette, il n’existe pas de structure de conduction bien définie mais plutôt des voies de conduction préférentielles (faisceau internodal antérieur, moyen et postérieur). Le faisceau de Bachmann naît du tissu internodal antérieur pour dépolariser l’oreillette gauche à travers le septum interatrial.
II Dysfonction sinusale (DS)
A Physiopathologie et mécanismes
• ![]() Le nœud sinusal est une structure en forme de croissant mesurant de 1 à 2 cm, situé dans l’atrium droit, au niveau de la jonction avec la veine cave supérieure et s’étendant vers le bas. Les cellules du nœud sinusal sont dotées d’un automatisme produisant de manière cyclique une activité électrique qui initie chaque nouveau battement cardiaque au cours du rythme sinusal normal (fréquence entre 50 et 100 bpm). On le considère comme le pacemaker naturel du cœur. L’activité électrique du nœud sinusal n’est pas enregistrée par l’ECG de surface car de trop faible amplitude.
Le nœud sinusal est une structure en forme de croissant mesurant de 1 à 2 cm, situé dans l’atrium droit, au niveau de la jonction avec la veine cave supérieure et s’étendant vers le bas. Les cellules du nœud sinusal sont dotées d’un automatisme produisant de manière cyclique une activité électrique qui initie chaque nouveau battement cardiaque au cours du rythme sinusal normal (fréquence entre 50 et 100 bpm). On le considère comme le pacemaker naturel du cœur. L’activité électrique du nœud sinusal n’est pas enregistrée par l’ECG de surface car de trop faible amplitude.
• Dans la DS, on définit de manière schématique d’une part les anomalies de l’automatisme sinusal et d’autre part les troubles de conduction avec perte de la transmission de son activité électrique à l’atrium droit par bloc sinoatrial.
• La DS est le plus souvent associée au vieillissement et généralement liée à un phénomène de fibrose. Elle affecte 0,03 % de la population et sa prévalence augmente avec l’âge.
• Elle est souvent associée à une atteinte plus globale de l’oreillette et à la fibrillation atriale, définissant dans ce cas la maladie de l’oreillette ou syndrome de bradycardie-tachycardie.
• Le nœud sinusal est sous étroite dépendance du système nerveux autonome. Le système sympathique augmente la fréquence de l’automatisme alors que le système parasympathique la diminue. La DS peut être parfois uniquement de mécanisme vagal.
• Le nœud sinusal est vascularisé par une branche de l’artère coronaire droite ou de l’artère circonflexe.
• La DS peut faire suite à la prise d’un médicament bradycardisant.
• En cas de DS permanente ou avec pauses prolongées, un rythme d’échappement peut éclore du NAV (rythme de secours).
B Aspects cliniques
1 Présentation clinique et symptômes
![]() La dysfonction sinusale peut :
La dysfonction sinusale peut :
• rester latente et asymptomatique pendant de nombreuses années ;
• s’accompagner de signes cliniques liés à la baisse du débit sanguin cérébral occasionnée par la réduction de la perfusion cérébrale en cas de bradycardie ou de pauses : lipothymies, syncopes à l’emporte-pièce (Adams-Stokes) ou symptômes plus trompeurs comme des pseudo-vertiges ;
• s’accompagner de signes liés à la réduction du débit cardiaque : réduction de la capacité à l’effort, dyspnée d’effort, asthénie chronique, angor ou insuffisance cardiaque ;
• être révélée par des palpitations ou par une embolie artérielle si elle est associée à une fibrillation atriale dans le cadre de la maladie rythmique atriale ;
• être parfois révélée chez l’octogénaire par une détérioration des fonctions cognitives.
2 Étiologies
On distingue les DS intrinsèques résultat d’un dysfonctionnement organique de la fonction du nœud sinusal (le plus souvent permanent) des causes extrinsèques (le plus souvent réversibles) (cf. encadré 14.1).
Encadré 14.1 Principales étiologies de la dysfonction sinusale
| Causes intrinsèques • • Maladie coronarienne chronique et aiguë : ischémie, infarctus • Cardiomyopathies, myocardites, cardiopathies congénitales, tumeurs cardiaques • Maladies infiltratives du myocarde (sarcoïdose, amylose, hémochromatose) ou systémiques (connectivites) • Post-chirurgicales : chirurgie valvulaire, cure de communication interatriale, transplantation • Troubles conductifs héréditaires, certaines cardiomyopathies ou dystrophies neuromusculaires héréditaires |
Causes extrinsèques • Prise médicamenteuse (bêtabloquant, inhibiteur calcique bradycardisant, amiodarone ou autre antiarythmique, ivabradine, digitalique, clonidine, etc.) • Origine vagale – Hypertonie vagale (athlète) – Réflexe vagal (malaise vasovagal), hypersensibilité sinocarotidienne • Atteinte du système nerveux central : hypertension intracrânienne, syndromes méningés • Troubles hydroélectrolytiques (hyperkaliémies) • Hypoxie, hypercapnie ou acidose sévères, syndrome d’apnées du sommeil • Hypothermie, hypothyroïdie, ictère rétentionnel sévère |
3 Diagnostic ECG
| • Constatation d’une bradycardie inappropriée en situation d’éveil < 50 bpm (et < 40/min la nuit chez l’adulte) • Mise en évidence d’une absence d’accélération de la fréquence cardiaque à l’effort (on parle d’incompétence chronotrope) ; • Mise en évidence de pauses sinusales sans onde P visible, considérées comme pathologiques au-delà de 3 secondes • Mise en évidence d’un bloc sinoatrial (BSA) du 2e ou 3e degré (cf. infra) • Syndrome bradycardie-tachycardie ou pauses post-réductionnelles • Pause sinusale symptomatique > 3 secondes induite par le massage sinocarotidien (hypersensibilité sinocarotidienne) ou le tilt-test |
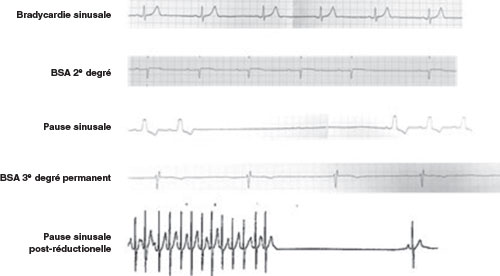
Pause ou arrêt sinusal (cf. fig. 14.2)
![]() Il s’agit soit d’une anomalie de l’automatisme sinusal soit d’un BSA du 3e degré paroxystique. On visualise une pause cardiaque sans onde P visible (asystolie) qui s’interrompt par une activité atriale différente de l’onde P sinusale (échappement atrial) ou par un complexe QRS jonctionnel non précédé d’onde P (échappement jonctionnel).
Il s’agit soit d’une anomalie de l’automatisme sinusal soit d’un BSA du 3e degré paroxystique. On visualise une pause cardiaque sans onde P visible (asystolie) qui s’interrompt par une activité atriale différente de l’onde P sinusale (échappement atrial) ou par un complexe QRS jonctionnel non précédé d’onde P (échappement jonctionnel).
Fig. 14.2 ![]() Principales anomalies électrocardiographiques observées dans le cadre de la dysfonction sinusale.
Principales anomalies électrocardiographiques observées dans le cadre de la dysfonction sinusale.
Bloc sinoatrial (cf. fig. 14.2 et fig. 14.3)
• Le BSA du 1er degré est défini par un allongement du temps de conduction entre le nœud sinusal et l’oreillette et n’a pas de traduction ECG.
• Le BSA du 2e degré se manifeste par un blocage intermittent de la conduction entre le nœud sinusal et l’oreillette.
– Dans le BSA du 2e degré de type I (Wenckebach sinoatrial), les ondes P se succèdent et sont irrégulières jusqu’à la survenue d’une pause sinusale de durée inférieure au double du cycle sinusal le plus court.
– Dans le BSA du 2e degré de type II, on observe des pauses inopinées ou régulières dont le cycle correspond à un multiple du cycle sinusal intrinsèque (2/1, 3/1).
• Le BSA du 3e degré consiste en une bradycardie à échappement jonctionnel (QRS fins) sans activité atriale sinusale visible (activité atriale rétrograde parfois visible).
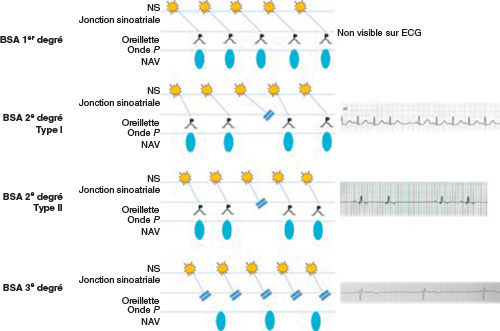
ECG : électrocardiogramme ; NAV : nœud atrioventriculaire ; NS : nœud sinsual.
Insuffisance chronotrope
Il s’agit d’une incapacité à accélérer suffisamment la fréquence sinusale spontanée lors de l’effort. On considère en général comme valeur seuil pathologique une fréquence cardiaque maximale inférieure à 80 % de la fréquence maximale théorique. Sur le tracé Holter, on observe une courbe de fréquence aplatie.
Bradycardie sinusale inappropriée
Certaines personnes présentent une bradycardie sinusale marquée (< 50 bpm le jour) en absence de causes extrinsèques pouvant expliquer la bradycardie. Elle est en général bien tolérée, des symptômes peuvent apparaître avec l’âge.
Maladie rythmique de l’oreillette
On différencie le syndrome brady/tachy (qui correspond à la coexistence chez un patient de dysfonction sinusale et de troubles du rythme atrial), des pauses post-réductionnelles (qui correspondent à des pauses sinusales à l’arrêt du trouble du rythme atrial en rapport avec une « sidération » du nœud sinusal) (cf. fig. 14.2).
4 Formes cliniques
Dysfonction sinusale dégénérative liée à l’âge
Souvent, il s’agit d’un patient qui reçoit de multiples médicaments. Il faut identifier la prise d’éventuels bradycardisants (bêtabloquants surtout, attention aux collyres), et se méfier chez le sujet âgé de signes trompeurs (chutes à répétition, déclin cognitif, etc.). La DS s’accompagne souvent dans ce cas de FA (maladie de l’oreillette avec syndrome brady/tachy ou pauses post-réductionnelles) et/ou de troubles conductifs touchant le NAV car la fibrose du nœud sinusal s’étend au NAV avec l’âge. Il faut souvent traiter.
Dysfonction sinusale par hypervagotonie
Il concerne souvent un sportif ou un jeune athlète (sport d’endurance, marathon, vélo, etc.) asymptomatique. La DS est liée à l’hypertonie vagale. Il ne faut pas traiter.
C Évaluation
1 Méthodes diagnostiques
• ![]() Le diagnostic repose sur l’enregistrement ECG : soit sur un enregistrement classique ECG 12D, soit au cours d’un monitorage ou d’un enregistrement selon la méthode de Holter. Il est nécessaire de confirmer que les anomalies ECG sont bien responsables des symptômes, cette corrélation est en général obtenue par l’enregistrement Holter avec tenue d’un journal des symptômes, il faut savoir répéter ou prolonger cet enregistrement si besoin. En cas de symptômes peu fréquents, un enregistreur externe de longue durée ou un moniteur implantable peut être proposé au patient.
Le diagnostic repose sur l’enregistrement ECG : soit sur un enregistrement classique ECG 12D, soit au cours d’un monitorage ou d’un enregistrement selon la méthode de Holter. Il est nécessaire de confirmer que les anomalies ECG sont bien responsables des symptômes, cette corrélation est en général obtenue par l’enregistrement Holter avec tenue d’un journal des symptômes, il faut savoir répéter ou prolonger cet enregistrement si besoin. En cas de symptômes peu fréquents, un enregistreur externe de longue durée ou un moniteur implantable peut être proposé au patient.
• Le test d’effort est utile pour diagnostiquer les insuffisances chronotropes.
• Le massage sinocarotidien peut permettre de mettre en évidence des pauses sinusales symptomatiques dans le cas de l’hypersensibilité sinocarotidienne. Si un mécanisme vagal est suspecté, le test d’inclinaison (tilt test) peut mettre en évidence des pauses sinusales ou un BSA d’origine vagale.
• ![]() L’exploration électrophysiologique endocavitaire (EEP) n’est pas recommandée de manière systématique mais peut être proposée en cas d’exploration de syncope (recommandations ESC 2018, classe IIb).
L’exploration électrophysiologique endocavitaire (EEP) n’est pas recommandée de manière systématique mais peut être proposée en cas d’exploration de syncope (recommandations ESC 2018, classe IIb).
2 Enquête étiologique
![]() Elle doit comporter au minimum une échocardiographie et un bilan biologique en cas de dysfonction sinusale sévère symptomatique (ionogramme sanguin, créatinine, troponine), la recherche clinique de causes extrinsèques, les autres examens sont réalisés sur signe d’appel.
Elle doit comporter au minimum une échocardiographie et un bilan biologique en cas de dysfonction sinusale sévère symptomatique (ionogramme sanguin, créatinine, troponine), la recherche clinique de causes extrinsèques, les autres examens sont réalisés sur signe d’appel.
3 Degré d’urgence de la prise en charge
![]() Il dépend du degré du trouble conductif et des symptômes. Les BSA du 3e degré et les syncopes avec dysfonction sinusale à l’ECG nécessitent une hospitalisation en urgence. Les autres cas peuvent être le plus souvent gérés de manière différée et ambulatoire.
Il dépend du degré du trouble conductif et des symptômes. Les BSA du 3e degré et les syncopes avec dysfonction sinusale à l’ECG nécessitent une hospitalisation en urgence. Les autres cas peuvent être le plus souvent gérés de manière différée et ambulatoire.
III Blocs atrioventriculaires
A Physiopathologie et mécanismes
• ![]() Le NAV est situé dans l’atrium droit en avant et en haut de l’ostium du sinus coronaire.
Le NAV est situé dans l’atrium droit en avant et en haut de l’ostium du sinus coronaire.
• Le faisceau de His est la seule communication entre atrium et ventricules et chemine dans le septum membraneux sous la racine de l’aorte.
• ![]() Les cellules nodales ont une conduction décrémentielle lente dépendante du courant entrant de calcium. Cela s’exprime par ce qu’on appelle le phénomène de Wenckebach qui voit s’allonger progressivement la conduction dans le NAV quand on stimule l’oreillette à une fréquence croissante jusqu’à atteindre la période réfractaire du NAV. Les cellules du His-Purkinje sont le siège d’une conduction rapide qui s’effectue selon la loi du « tout ou rien ».
Les cellules nodales ont une conduction décrémentielle lente dépendante du courant entrant de calcium. Cela s’exprime par ce qu’on appelle le phénomène de Wenckebach qui voit s’allonger progressivement la conduction dans le NAV quand on stimule l’oreillette à une fréquence croissante jusqu’à atteindre la période réfractaire du NAV. Les cellules du His-Purkinje sont le siège d’une conduction rapide qui s’effectue selon la loi du « tout ou rien ».
• ![]() Le NAV est aussi sous étroite dépendance du système nerveux autonome contrairement au His-Purkinje. Le système sympathique augmente la vitesse de conduction dans le NAV quand le système parasympathique la diminue.
Le NAV est aussi sous étroite dépendance du système nerveux autonome contrairement au His-Purkinje. Le système sympathique augmente la vitesse de conduction dans le NAV quand le système parasympathique la diminue.
• ![]() Le NAV est vascularisé le plus souvent par une branche de l’artère coronaire droite qui naît de la croix des sillons (artère du NAV). Le faisceau de His et ses branches sont vascularisés par la première branche septale de l’interventriculaire antérieure et par l’artère du NAV.
Le NAV est vascularisé le plus souvent par une branche de l’artère coronaire droite qui naît de la croix des sillons (artère du NAV). Le faisceau de His et ses branches sont vascularisés par la première branche septale de l’interventriculaire antérieure et par l’artère du NAV.
• ![]() En cas de BAV complet, la tolérance et le pronostic dépendent surtout des propriétés des foyers de suppléance (échappement). Plus ce foyer est bas situé, plus il est lent et instable. En cas de BAV complet de siège nodal, les rythmes d’échappement sont nodohissiens hauts assurant une fréquence stable entre 40 et 60/min. En cas de BAV infranodaux, c’est-à-dire dans le faisceau de His ou infrahissiens, le rythme d’échappement est instable et plus lent (15 à 40/min) pouvant être la source d’asystolie plus ou moins longue, ce qui fait la gravité de cette localisation.
En cas de BAV complet, la tolérance et le pronostic dépendent surtout des propriétés des foyers de suppléance (échappement). Plus ce foyer est bas situé, plus il est lent et instable. En cas de BAV complet de siège nodal, les rythmes d’échappement sont nodohissiens hauts assurant une fréquence stable entre 40 et 60/min. En cas de BAV infranodaux, c’est-à-dire dans le faisceau de His ou infrahissiens, le rythme d’échappement est instable et plus lent (15 à 40/min) pouvant être la source d’asystolie plus ou moins longue, ce qui fait la gravité de cette localisation.
• ![]() Les BAV sont le plus souvent liés au vieillissement et sont fréquents chez le sujet âgé.
Les BAV sont le plus souvent liés au vieillissement et sont fréquents chez le sujet âgé.
• ![]() On considère leur prévalence à 4/10 000 dans la population adulte, prévalence qui augmente avec l’âge.
On considère leur prévalence à 4/10 000 dans la population adulte, prévalence qui augmente avec l’âge.
B Aspects cliniques
1 Présentation clinique
![]() Un BAV peut :
Un BAV peut :
• être totalement asymptomatique, c’est le cas du BAV du 1er degré et de la plupart des BAV du 2e degré ;
• s’accompagner de signes cliniques liés à la baisse du débit sanguin cérébral en cas de bradycardie ou de pauses : lipothymies, syncopes à l’emporte-pièce (Adams-Stokes) ou symptômes plus trompeurs comme des pseudo-vertiges ;
• s’accompagner de signes liés à la réduction du débit cardiaque : réduction de la capacité à l’effort, dyspnée, asthénie chronique, angor ou insuffisance cardiaque en cas de BAV chronique avec bradycardie permanente (ou plus rarement de BAV du 1er degré avec PR très long) ;
• se manifester à l’effort uniquement dans le cas de BAV « fréquence-dépendant » habituellement de siège intra- ou infrahissien se manifestant par dyspnée, angor ou blockpnée d’effort ;
• être révélé chez l’octogénaire par une détérioration des fonctions cognitives ;
• être révélé ou s’accompagner de fibrillation ventriculaire consécutive à une torsade de pointes (favorisée par la bradycardie et l’allongement de l’intervalle QT) (cf. fig. 14.4).
Fig. 14.4 ![]() Exemple de torsade de pointes chez un patient avec un BAV (bloc atrioventriculaire) complet.
Exemple de torsade de pointes chez un patient avec un BAV (bloc atrioventriculaire) complet.
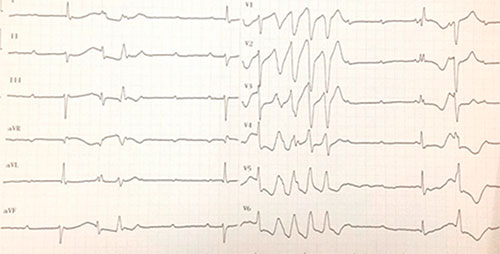
Dans ce cas, la torsade de pointes est favorisée par l’allongement de l’intervalle QT et la bradycardie induite par le BAV3. Le traitement consiste en l’accélération de la fréquence cardiaque par isoprénaline et/ou stimulation cardiaque.
2 Étiologies
De très nombreuses affections peuvent être responsables de BAV. La cause la plus fréquente chez le sujet âgé est la cause dégénérative liée au vieillissement (cf. encadré 14.2).
Encadré 14.2 Principales étiologies des blocs atrioventriculaires
| Causes intrinsèques • • Maladie coronarienne chronique • Infarctus du myocarde De siège nodal dans l’infarctus inférieur, de bon pronostic car le plus souvent régressif De siège hissien ou infrahissien dans l’infarctus antérieur, de très mauvais pronostic car témoin d’infarctus très étendu avec insuffisance cardiaque ou choc cardiogénique • Cardiomyopathies, malformations cardiaques, tumeurs cardiaques • Maladies infiltratives du myocarde (sarcoïdose, amylose, hémochromatose) ou systémiques (connectivites) • Post-chirurgicales : chirurgie valvulaire ou TAVI, des cardiopathies congénitales, myomectomie septale • Traumatique suite à un cathétérisme ou ablation par radiofréquence • Troubles conductifs héréditaires, certaines cardiomyopathies ou maladies neuromusculaires héréditaires • Radique post-radiothérapie • Infectieuses : – endocardites bactériennes (abcès de l’anneau) – myocardite de la maladie de Lyme – myocardites virales • Rétrécissement aortique calcifié dégénératif • BAV congénital Causes extrinsèques • Prise médicamenteuse (bêtabloquant, inhibiteur calcique bradycardisant, amiodarone ou autre antiarythmique, digitalique) • Hypertonie vagale (athlète) ou réflexe vagal (malaise vasovagal) • Troubles hydroélectrolytiques (hyperkaliémies) |
Du fait de sa faible sensibilité aux facteurs extrinsèques, le His-Purkinje est plus souvent le siège de BAV dégénératifs (paroxystiques ou permanents). Les BAV peuvent être permanents ou paroxystiques. Une cause aiguë réversible doit être recherchée, en particulier : ischémique, métabolique, infectieuse ou inflammatoire, médicamenteuse.
3 Diagnostic ECG
• ![]() Il faut préciser le type de bloc : 1er, 2e ou 3e degré, son caractère paroxystique ou permanent, son caractère congénital ou acquis, et surtout son siège (nodal ou infranodal, cf. tableau 14.1).
Il faut préciser le type de bloc : 1er, 2e ou 3e degré, son caractère paroxystique ou permanent, son caractère congénital ou acquis, et surtout son siège (nodal ou infranodal, cf. tableau 14.1).
• Le diagnostic est toujours électrocardiographique, soit sur un enregistrement classique ECG 12D, soit au cours d’un monitorage ou d’un enregistrement Holter, soit au cours d’une EEP endocavitaire.
• Les blocs nodaux sont souvent responsables de BAV du 1er degré ou de BAV du 2e degré type Mobitz I, ou de BAV complet à échappement nodohissien stable à QRS fins à 40-60 bpm. Ils sont améliorés par l’atropine, l’isoprénaline et l’effort. Ils sont aggravés par le massage sinocarotidien.
• Les blocs dans le faisceau de His ou infrahissiens surviennent au préalable sur des blocs de branche et sont responsables de BAV du 2e degré de type Mobitz II et de BAV du 3e degré à échappement infranodal. Lorsqu’ils sont complets, il y a un risque de décès par asystolie et torsades de pointes, le rythme d’échappement est inconstant, instable et lent < 35–40 bpm. Ils sont améliorés par le massage sinocarotidien et l’isoprénaline et aggravés par l’atropine et l’effort.
• La morphologie du complexe QRS ne permet pas toujours à elle seule d’évaluer le siège du bloc mais une durée de QRS < 120 ms est très en faveur d’un bloc nodal (cf. infra). Les BAV intrahissiens sont rares mais constituent un piège classique car les QRS sont en général fins.
Les caractéristiques ECG sont les suivantes (cf. fig. 14.5) :
• BAV du 1er degré : allongement fixe et constant de PR > 200 ms ;
• BAV du 2e degré de type Mobitz I ou Luciani-Wenckebach :
– allongement progressif de PR jusqu’à l’observation d’une seule onde P, bloquée suivie d’une onde P conduite avec un intervalle PR plus court,
– parfois associé à un BAV 2:1,
– en règle, de siège nodal et le plus souvent à QRS fins (< 120 ms) ;
Tableau 14.1 ![]() Classification des blocs atrioventriculaires (BAV).
Classification des blocs atrioventriculaires (BAV).
| Degré | Siège | QRS | Symptômes |
|---|---|---|---|
| BAV 1er degré | QRS fins sauf BB associé | QRS fins sauf BB associé | Non (sauf PR très long) |
| BAV 2e degré Mobitz I | Toujours nodal | QRS fins sauf BB associé | ± |
| BAV 2e degré Mobitz II | Toujours de siège hissien ou infrahissien | QRS fins (intrahissien) ou plus souvent larges (BB associé) | ± |
| BAV de haut degré | Hissien ou infrahissien Rarement nodal |
QRS larges QRS fins si nodal ou intrahissien (sauf BB associé) |
Oui |
| BAV 3e degré (BAV complet) | Nodal, hissien ou infrahissien | Échappement QRS fins si nodal/intrahissien sauf BB associé Échappement QRS larges si infrahissien |
Oui |
BB : bloc de branche.
• BAV du 2e degré de type Mobitz II :
– pas d’allongement ni de raccourcissement de l’intervalle PR,
– survenue inopinée d’une seule onde P bloquée,
– évolution fréquente vers le BAV complet,
– en règle, de siège infranodal et le plus souvent à QRS larges ;
Fig. 14.5 Différents degrés et manifestations électrocardiographiques des blocs atrioventriculaires (BAV).

AV : nœud atrioventriculaire ; FA : fibrillation atriale.
• BAV de haut degré (parfois assimilé au type Mobitz II) :
– plusieurs ondes P bloquées consécutives,
– ou conduction rythmée, par exemple 2 ondes P bloquées et une conduite (on parle de 3:1),
– évolution fréquente vers le BAV complet,
– en règle, de siège infranodal et le plus souvent à QRS larges ;
• BAV du 2e degré de type 2:1 :
– inclassable en Mobitz I ou II,
– 2 ondes P pour un QRS,
– largeur de QRS = élément d’orientation pour le siège du bloc (QRS larges en faveur du siège infranodal) ;
• BAV du 3e degré ou complet :
– aucune onde P conduite,
– activités atriale et ventriculaire dissociées,
– battements des ventricules plus lents que ceux de l’atrium, par échappement de hauteur variable en fonction du siège du bloc,
– siège du bloc orienté par la durée de QRS et la fréquence de l’échappement,
– intervalle QT susceptible de s’allonger et risque de décès par torsades de pointes ;
• BAV complet et fibrillation/flutter atrial :
– bradycardie au lieu de la tachycardie usuelle de la FA,
– rythme régulier au lieu des irrégularités liées à la FA,
– QRS de durée variable en fonction du siège du bloc.
4 Quelques formes cliniques typiques
BAV dégénératif du sujet âgé
Il s’agit de la forme clinique la plus fréquente. Chez le sujet âgé, les symptômes peuvent être atypiques (activité réduite, bas débit cérébral). Il faut toujours évoquer une cause iatrogène possible (médicaments). La largeur du QRS donne souvent le siège du bloc.
BAV complet sur infarctus
Il est observé dans 2-5 % des cas, de manière plus fréquente dans les infarctus du myocarde (IDM) inférieurs que dans les IDM antérieurs.
• Dans les IDM inférieurs, son siège est en règle générale nodal (> 90 % des cas). Il survient de manière progressive, souvent précédé de BAV du 1er puis du 2e degré à QRS fins, parfois asymptomatiques. Au stade de BAV du 3e degré, l’échappement est le plus souvent à QRS fins. Le mécanisme peut être vagal quand il survient de manière précoce ou être lié à l’ischémie. Il est alors le témoin d’une atteinte de l’artère du NAV, plutôt de bon pronostic en soi, bien qu’associée à une surmortalité car associé à des dégâts myocardiques souvent étendus et à un âge plus avancé. Le bloc est parfois favorisé par les bêtabloquants ou la reperfusion ; le BAV fait contre-indiquer les bêtabloquants en aigu. Il est en règle régressif. Il répond bien à l’atropine et peut parfois nécessiter une stimulation temporaire s’il est mal toléré, l’isoprénaline étant contre-indiquée dans le contexte d’IDM aigu. S’il est non régressif à J5, il fait discuter la pose d’un stimulateur.
• Les BAV survenant dans le contexte d’IDM antérieur sont beaucoup plus rares et de siège infranodal. Ils témoignent le plus souvent d’un IDM étendu. Ils surviennent brutalement, souvent précédés par un bloc de branche. Ils sont associés à une importante mortalité liée à l’étendue de la nécrose. Une stimulation temporaire est le plus souvent nécessaire, l’isoprénaline étant contre-indiquée dans le contexte d’IDM aigu, et ils nécessitent plus fréquemment une stimulation définitive en cas de non-régression.
BAV congénital
![]() Il représente 3 à 5 % des BAV et touche plutôt les filles (60 %). Il concerne une naissance sur 20 000. Il est le plus souvent de cause immunologique, lié à un passage transplacentaire d’anticorps maternels anti-Ro/SSA chez une mère atteinte d’un lupus érythémateux ou d’un syndrome de Goujerot-Sjögren. Il s’agit parfois de BAV de cause génétique. Ce peut être un diagnostic de bradycardie fœtale ou néonatale.
Il représente 3 à 5 % des BAV et touche plutôt les filles (60 %). Il concerne une naissance sur 20 000. Il est le plus souvent de cause immunologique, lié à un passage transplacentaire d’anticorps maternels anti-Ro/SSA chez une mère atteinte d’un lupus érythémateux ou d’un syndrome de Goujerot-Sjögren. Il s’agit parfois de BAV de cause génétique. Ce peut être un diagnostic de bradycardie fœtale ou néonatale.
BAV chez les patients en FA permanente
On parle dans ce cas de bradyarythmie (à ne pas confondre avec la maladie rythmique atriale qui associe FA le plus souvent paroxystique et dysfonction sinusale). Il s’agit d’un tableau de FA permanente lente avec des pauses pathologiques (> 3 secondes) ou avec un rythme lent régulier (BAV3) ou irrégulier (BAV2).
C Évaluation et prise en charge
• ![]() Le contexte clinique du diagnostic est celui d’une bradycardie en situation d’éveil ou celui de l’évaluation d’une lipothymie ou d’une syncope.
Le contexte clinique du diagnostic est celui d’une bradycardie en situation d’éveil ou celui de l’évaluation d’une lipothymie ou d’une syncope.
• Si le bloc est permanent, l’ECG suffit au diagnostic.
• Les bradycardies à risque vital nécessitant une hospitalisation sont les BAV du 3e degré, les BAV du 2e degré Mobitz II, les BAV de haut degré, les blocs alternants, ainsi que les syncopes avec troubles conductifs à l’ECG. Les autres cas peuvent être le plus souvent gérés de manière différée en ambulatoire.
• ![]() La méthode de référence est l’enregistrement Holter pour les blocs nodaux et l’étude endocavitaire pour les blocs infrahissiens ou hissiens.
La méthode de référence est l’enregistrement Holter pour les blocs nodaux et l’étude endocavitaire pour les blocs infrahissiens ou hissiens.
• En cas de suspicion de BAV paroxystique de siège infranodal dans le cadre du bilan d’une syncope en présence de troubles conductifs intraventriculaires (bloc de branche ou bloc bifasciculaire) sur l’ECG, il faut proposer une EEP endocavitaire pour mesurer l’intervalle HV. Un intervalle HV ≥ 70 ms est considéré comme pathologique signant une atteinte infrahissienne. Le bloc intrahissien se manifeste par un intervalle hissien (H) dédoublé (H1-H2) et est beaucoup plus rare.
• ![]() L’enquête étiologique commence par rechercher une cause aiguë curable ou spontanément réversible : syndrome coronarien aigu (dans le territoire inférieur surtout), prise de médicament bradycardisant, hyperkaliémie ou parfois myocardite.
L’enquête étiologique commence par rechercher une cause aiguë curable ou spontanément réversible : syndrome coronarien aigu (dans le territoire inférieur surtout), prise de médicament bradycardisant, hyperkaliémie ou parfois myocardite.
• L’enquête étiologique doit comporter au minimum : un ionogramme sanguin, une échocardiographie et un dosage des troponines ; les autres examens sont réalisés selon le contexte.
• Chez le sujet jeune (< 50 ans) ou en cas de contexte clinique évocateur, le bilan doit être plus poussé en particulier à la recherche d’une myocardite de cause inflammatoire/infectieuse avec IRM cardiaque ou d’une cause génétique.
IV Blocs de branche
A Physiopathologie et mécanismes
• ![]() Le faisceau de His se divise en une branche droite et une gauche, qui se subdivise en fascicules ou hémibranches : antérieure fine et postérieure épaisse.
Le faisceau de His se divise en une branche droite et une gauche, qui se subdivise en fascicules ou hémibranches : antérieure fine et postérieure épaisse.
• Les branches sont peu sensibles aux effets du système nerveux autonome.
• Elles se ramifient en réseau de Purkinje et ont la même nature histologique que lui. Les cellules sont peu sensibles à l’ischémie et sont quasiment dépourvues d’activité mécanique.
• ![]() Dans le bloc de branche, on observe un ralentissement ou interruption de la conduction dans une branche.
Dans le bloc de branche, on observe un ralentissement ou interruption de la conduction dans une branche.
B Aspects cliniques
1 Présentation clinique
• Un bloc de branche est toujours asymptomatique s’il est isolé.
• Un bloc de branche est de découverte :
– soit fortuite, par un ECG pratiqué lors d’une visite de contrôle ;
– soit au cours du suivi d’une maladie cardiovasculaire.
• Accompagné de lipothymies ou de syncopes, il prend une valeur de gravité immédiate pour deux raisons : il peut signer la présence d’une cardiopathie (c’est surtout vrai pour le bloc de branche gauche) ou suggère un BAV paroxystique comme cause des symptômes.
2 Étiologies
• ![]() Le bloc de branche droit (BBD) isolé peut être bénin et considéré comme une variante de la normale, qu’il soit complet ou incomplet mais peut parfois témoigner d’une cardiopathie sous-jacente en particulier du ventricule droit. Le bloc de branche droit est quasi systématiquement observé dans la plupart des cardiopathies congénitales touchant le ventricule droit et surtout dans la pathologie pulmonaire avec retentissement cardiaque (hypertension pulmonaire, séquelle d’embolie pulmonaire, etc.).
Le bloc de branche droit (BBD) isolé peut être bénin et considéré comme une variante de la normale, qu’il soit complet ou incomplet mais peut parfois témoigner d’une cardiopathie sous-jacente en particulier du ventricule droit. Le bloc de branche droit est quasi systématiquement observé dans la plupart des cardiopathies congénitales touchant le ventricule droit et surtout dans la pathologie pulmonaire avec retentissement cardiaque (hypertension pulmonaire, séquelle d’embolie pulmonaire, etc.).
• Le bloc de branche gauche (BBG) n’est jamais considéré comme bénin, il est soit dégénératif, soit associé à une cardiopathie.
• Au cours d’un syndrome coronarien aigu, on peut observer l’apparition d’un bloc de branche droit ou gauche. Au cours de l’infarctus antérieur, l’apparition d’un bloc de branche gauche est le témoin d’une atteinte infrahissienne de mauvais pronostic car associée à des lésions très étendues avec insuffisance cardiaque ou choc cardiogénique.
• Les autres causes sont identiques à celles des BAV : les causes électrolytiques sont dominées par l’hyperkaliémie, les médicaments qui bloquent le courant de sodium comme les antiarythmiques de classe I (ex : flécaïnide) ou les antidépresseurs tricycliques.
3 Diagnostic ECG
![]() Cf. chapitre 15 pour des illustrations plus détaillées.
Cf. chapitre 15 pour des illustrations plus détaillées.
Il faut :
• préciser le type de bloc :
– incomplet pour une durée de QRS ≤ 120 ms ; dans ce cas, il a peu de valeur sémiologique ou clinique,
– complet si la durée de QRS dépasse 120 ms ;
• préciser ensuite s’il est de branche droite (QRS positif en V1) ou de branche gauche (QRS négatif en V1) ou bifasciculaire ou trifasciculaire (cf. chapitre 15) ;
Il faut d’abord vérifier que le rythme est sinusal à fréquence normale, cependant un bloc de branche peut être associé à une tachycardie supraventriculaire (ex : fibrillation atriale).
Les caractéristiques ECG sont les suivantes.
BBD complet
• Durée de QRS > 120 ms.
• Axe normal.
• En V1 : QRS positif avec aspect rsR’.
• En V6 : aspect qRs avec onde S traînante et le plus souvent arrondie.
• En aVR : aspect qR.
• Ondes T en général négatives en V1-V2, parfois V3 ne devant pas faire évoquer à tort une ischémie myocardique.
BBG complet
• Durée de QRS > 120 ms.
• Axe normal ou gauche.
• En V1 : QRS négatif avec aspect rS ou QS.
• En aVR : aspect QS.
• En D1, V6 : R avec notch.
• Ondes T en général négatives en D1, aVL, V5-V6 ne devant pas faire évoquer à tort une ischémie myocardique.
• Éventuel léger sus-décalage de ST en V1-V2-V3 ne devant pas faire évoquer à tort un SCA avec sus-ST mais qui ne dépasse pas 1 mm le plus souvent. Le diagnostic d’infarctus est gêné par le bloc de branche gauche ; dans ce cas, la prise en charge devient celle d’un SCA avec sus-décalage de ST.
Hémibloc ou bloc fasciculaire antérieur gauche (HBAG)
• Déviation axiale du QRS gauche de –45 à –75° (en pratique –30° ou aVL).
• Durée de QRS < 120 ms. • En D1-aVL : aspect qR. • En D2, D3, aVF : aspect rS (on retient le moyen mnémotechnique S3 > S2).
• En V6 : onde S.
Hémibloc ou bloc fasciculaire postérieur gauche (HBPG)
• Déviation axiale du QRS droite > 100° (en pratique + 90° ou négativité en D1) en l’absence de pathologie du ventricule droit ou de morphologie longiligne.
• Durée de QRS < 120 ms.
• En D1-aVL : aspect RS ou Rs.
• En D2, D3, aVF : aspect qR (on retient le moyen mnémotechnique S1Q3 cad onde S en D1 et onde Q en D3).
Blocs bifasciculaires
La sémiologie s’additionne : BBD + HBAG ou BBD + HBPG.
4 Quelques formes cliniques typiques
Bloc bifasciculaire avec perte de connaissance
Le plus souvent, il s’agit d’une association de bloc de branche droit et d’hémibloc antérieur (plus rarement postérieur) gauche. Il peut y avoir un BAV du 1er degré associé. Il faut rechercher une cardiopathie sous-jacente et réaliser, en cas de symptômes ou de certaines pathologies, une étude endocavitaire pour mesurer la conduction infrahissienne qui peut conduire, si elle est pathologique (intervalle HV ≥ 70 ms), à la mise en place d’un stimulateur cardiaque.
Blocs de branche de l’infarctus antérieur
Un bloc de branche est observé dans 10 % des cas, à type de bloc uni, bi ou trifasciculaire, soit préexistant, soit acquis pendant l’infarctus. Ce dernier cas évoque une nécrose septale étendue, avec risque de survenue brutale d’un BAV complet et asystolie ou d’un trouble du rythme ventriculaire associé.
Bloc alternant
C’est une association successive de BBD complet et de BBG complet ou une alternance d’hémibloc antérieur gauche et d’hémibloc postérieur gauche sur fond de BBD complet. C’est un bloc trifasciculaire et un équivalent de BAV complet paroxystique de siège infrahissien, donc grave.
C Évaluation et prise en charge
• ![]() La constatation d’un BBG doit faire rechercher une hypertension artérielle méconnue ou une cardiopathie sous-jacente, à défaut c’est un bloc dégénératif. Il faut rechercher une pathologie pulmonaire ou du VD en cas de BBD. Il faut réaliser une échographie cardiaque à la recherche d’une cardiopathie éventuellement complétée par d’autres investigations selon les points d’appel cliniques.
La constatation d’un BBG doit faire rechercher une hypertension artérielle méconnue ou une cardiopathie sous-jacente, à défaut c’est un bloc dégénératif. Il faut rechercher une pathologie pulmonaire ou du VD en cas de BBD. Il faut réaliser une échographie cardiaque à la recherche d’une cardiopathie éventuellement complétée par d’autres investigations selon les points d’appel cliniques.
• ![]() En dehors de symptôme particulier aigu (douleur thoracique, syncope ou malaise, dyspnée), les explorations pourront se faire de manière non urgente.
En dehors de symptôme particulier aigu (douleur thoracique, syncope ou malaise, dyspnée), les explorations pourront se faire de manière non urgente.
• La constatation isolée d’un BBD chez un sujet jeune, asymptomatique dont l’examen clinique est normal, peut être considérée comme une variante de la normale.
• ![]() En cas de syncope sur cardiopathie, un bloc de branche isolé ne peut à lui seul être tenu comme une indication fiable que la perte de connaissance est due à un BAV paroxystique. Il faut aussi évoquer la possibilité d’une tachycardie ventriculaire. En l’absence de documentation de BAV du 2e ou du 3e degré, la prise en charge d’un patient avec bloc de branche et perte de connaissance nécessite le plus souvent une EEP endocavitaire.
En cas de syncope sur cardiopathie, un bloc de branche isolé ne peut à lui seul être tenu comme une indication fiable que la perte de connaissance est due à un BAV paroxystique. Il faut aussi évoquer la possibilité d’une tachycardie ventriculaire. En l’absence de documentation de BAV du 2e ou du 3e degré, la prise en charge d’un patient avec bloc de branche et perte de connaissance nécessite le plus souvent une EEP endocavitaire.
V Thérapeutique et suivi du patient
A Situations d’urgence et signes de gravité
• ![]() Il faut évaluer la tolérance de la bradycardie en évaluant la tolérance hémodynamique. La mauvaise tolérance peut se traduire par une lipothymie ou une syncope, un angor, une insuffisance cardiaque, des signes de choc avec hypotension artérielle, une oligurie ou des signes neurologiques.
Il faut évaluer la tolérance de la bradycardie en évaluant la tolérance hémodynamique. La mauvaise tolérance peut se traduire par une lipothymie ou une syncope, un angor, une insuffisance cardiaque, des signes de choc avec hypotension artérielle, une oligurie ou des signes neurologiques.
• La prise en charge dépend bien sûr du type de trouble conductif, du contexte clinique et de la tolérance. Les bradycardies à risque vital nécessitant une hospitalisation urgente sont les BAV3, les BAV2 Mobitz II, les BAV de haut degré, les blocs alternants, les BSA du 3e degré et les syncopes avec troubles conductifs à l’ECG. Une bradycardie par BAV complet est toujours plus grave qu’une bradycardie par DS en raison d’un risque plus élevé de torsades de pointes et d’asystolie. Dans les autres cas de figure, la prise en charge peut le plus souvent être différée en ambulatoire.
• La prise en charge immédiate d’une bradycardie mal tolérée impose une thérapeutique visant à restaurer une fréquence ventriculaire adaptée.
• Dans ces cas, il s’agit d’une urgence vitale imposant le transfert en USIC, patient sous scope ECG, et surveillance des paramètres vitaux (pouls, PA, fréquence respiratoire, saturation, diurèse).
• On doit toujours traiter la cause si elle existe, en particulier on recherche une cause ischémique (IDM), la prise de médicament bradycardisant, et une hyperkaliémie.
– Il faut rechercher un IDM aigu en recherchant un sus-décalage du segment ST sur l’ECG, une douleur thoracique et un dosage de troponine. En cas de bloc de branche gauche ou de BAV avec échappement à QRS larges, l’ECG est non informatif pour le diagnostic de l’IDM et une coronarographie urgente est à discuter en cas de suspicion clinique.
– Il faut toujours rechercher une hyperkaliémie qui peut donner des troubles conductifs à tous les étages, surtout dans des contextes à risque (insuffisance rénale connue, prise de médicament hyperkaliémiant, etc.). On peut retrouver des ondes T amples et pointues sur l’ECG.
• Il faut aussi faire une échocardiographie à la recherche d’une cardiopathie associée et évaluer la fonction ventriculaire gauche.
• En présence d’une bradycardie, en particulier de BAV3, il est nécessaire d’éviter les molécules allongeant le QT et de corriger une hypokaliémie pour limiter le risque de torsade de pointes. La survenue de torsade de pointes est un signe de gravité.
• Il faut se tenir prêt à devoir engager une réanimation cardiorespiratoire et à poser une sonde d’entraînement percutanée en cas d’échec des médicaments ou de la stimulation transthoracique, ou en cas de survenue de trouble du rythme ventriculaire.
B Moyens thérapeutiques
• ![]() Les moyens médicamenteux disponibles sont les substances tachycardisantes (effets chronotrope et dromotrope positifs) comme l’atropine ou l’isoprénaline (= isoprotérénol). L’atropine, que l’on prescrit en bolus IV, n’a qu’une action transitoire exclusivement sur les BAV nodaux ou la DS. On privilégie l’usage de l’isoprénaline en perfusion continue qui a une action prolongée et est efficace sur l’ensemble des troubles conductifs en général. Ce sont des traitements temporaires indiqués dans le cadre de l’urgence, dans l’attente soit de la résolution du trouble conductif, soit de l’appareillage définitif.
Les moyens médicamenteux disponibles sont les substances tachycardisantes (effets chronotrope et dromotrope positifs) comme l’atropine ou l’isoprénaline (= isoprotérénol). L’atropine, que l’on prescrit en bolus IV, n’a qu’une action transitoire exclusivement sur les BAV nodaux ou la DS. On privilégie l’usage de l’isoprénaline en perfusion continue qui a une action prolongée et est efficace sur l’ensemble des troubles conductifs en général. Ce sont des traitements temporaires indiqués dans le cadre de l’urgence, dans l’attente soit de la résolution du trouble conductif, soit de l’appareillage définitif.
• La stimulation cardiaque temporaire peut être percutanée (sonde d’entraînement électrosystolique ou stimulateur externe temporaire) ou transthoracique. Il s’agit d’un mode de stimulation temporaire indiqué dans le cadre de l’urgence, le plus souvent en cas de non-réponse à l’isoprénaline et de mauvaise tolérance hémodynamique. La mise en place d’une sonde d’entraînement est un geste qui peut être associé à certaines complications (tamponnade). La stimulation externe transthoracique est douloureuse et demeure une solution d’attente de l’efficacité de l’isoprénaline ou de la mise en place d’une stimulation cardiaque temporaire percutanée.
• En cas de torsade de pointes, il faut accélérer la fréquence cardiaque de manière efficace par isoprénaline ou stimulation percutanée, corriger une hypomagnésémie/hypokaliémie et arrêter tout médicament allongeant le QT.
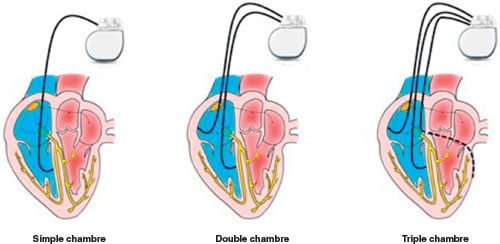
• En cas de trouble conductif symptomatique ou de haut degré sans cause réversible retrouvée, le traitement consiste en l’implantation d’un stimulateur cardiaque définitif. Les stimulateurs peuvent être simple, double ou triple chambre (cf. fig. 14.6).
• Les stimulateurs cardiaques sont implantés par voie subclavière en règle générale. On distingue par exemple les stimulateurs simple chambre qui stimulent les ventricules via une électrode vissée dans le ventricule droit et fonctionnent en mode VVI (cf. infra). Les stimulateurs double chambres stimulent successivement l’oreillette via une sonde vissée dans l’oreillette droite puis le ventricule en mode double chambre (DDD). Il existe aussi des stimulateurs biventriculaires qui stimulent simultanément le ventricule droit et le ventricule gauche via une sonde supplémentaire introduite dans une branche veineuse latérale gauche du sinus coronaire (resynchronisation). Depuis quelques années, des stimulateurs cardiaques sans sonde existent. Il s’agit d’une capsule que l’on implante par voie veineuse fémorale au niveau du ventricule droit. Pour l’instant, il s’agit de stimulateurs ne pouvant stimuler que le ventricule droit.
Fig. 14.6 ![]() Principaux types de stimulateur cardiaque endocavitaire.
Principaux types de stimulateur cardiaque endocavitaire.
• ![]() La programmation des stimulateurs (pacemakers) est classée en fonction du mode de stimulation utilisé. La nomenclature utilise un code à 3 lettres :
La programmation des stimulateurs (pacemakers) est classée en fonction du mode de stimulation utilisé. La nomenclature utilise un code à 3 lettres :
– 1re lettre : cavité stimulée. On utilise A pour oreillette, V pour ventricule, D pour double (oreillette + ventricule) ;
– 2e lettre : cavité où l’activité électrique est détectée, selon le même code ;
– 3e lettre : mode de fonctionnement : I pour « inhibé », T (triggered) pour « déclenché », D pour un mode mixte « inhibé + déclenché » ;
– 4e lettre R : programmation de l’asservissement (= accélération de la fréquence de stimulation avec l’activité physique).
• ![]() La pose d’un stimulateur est un geste effectué sous anesthésie locale ou sous sédation au bloc opératoire après consentement éclairé du patient et avec une asepsie rigoureuse en raison des risques infectieux.
La pose d’un stimulateur est un geste effectué sous anesthésie locale ou sous sédation au bloc opératoire après consentement éclairé du patient et avec une asepsie rigoureuse en raison des risques infectieux.
C Indications de stimulation cardiaque définitive
• Dans la dysfonction sinusale :
– uniquement lorsqu’elle est symptomatique avec preuve du lien de causalité entre bradycardie et symptômes et uniquement en l’absence de cause réversible. Une exception à cette règle peut être l’impossibilité de stopper des bradycardisants requis pour contrôler une fibrillation atriale dans le cadre de la maladie rythmique atriale symptomatique ou un angor (par exemple). Le stimulateur cardiaque est aussi recommandé en cas de syncopes avec pauses sinusales significatives (> 3 secondes symptomatiques ou > 6 secondes asymptomatiques) ou de syndrome du sinus carotidien documentés chez les sujets de plus de 40 ans. ;
– parfois dans les bradycardies sévères diurnes < 40 bpm à symptômes modestes et les insuffisances chronotropes symptomatiques.
• Dans les BAV :
– BAV3 : en l’absence de cause curable ou réversible ;
– BAV2 : lorsqu’ils sont évocateurs d’un siège infrahissien ou bien lorsqu’ils sont symptomatiques quel que soit leur siège. Les blocs alternants sont également une indication ;
– en cas de mise en évidence de bloc infranodal à l’EEP avec HV ≥ 70 ms en cas de syncope.
• ![]() Les recommandations européennes 2021 de stimulation cardiaque définitive sont résumées dans le tableau 14.2.
Les recommandations européennes 2021 de stimulation cardiaque définitive sont résumées dans le tableau 14.2.
Tableau 14.2 ![]() Résumé des recommandations de l’ESC 2021 sur les indications de stimulation cardiaque définitive.
Résumé des recommandations de l’ESC 2021 sur les indications de stimulation cardiaque définitive.
| Pour la maladie du nœud sinusal : la stimulation cardiaque définitive… | Classe | Niveau de preuve |
|---|---|---|
| Est indiquée quand les symptômes sont clairement attribuables à la bradycardie observée | I | B |
| Peut être proposée si les symptômes sont probablement attribuables à la bradycardie, même en l’absence de preuve définitive | IIb | C |
| Est indiquée chez les patients symptomatiques avec un syndrome brady-tachy afin de corriger la bradycardie et permettre la mise en place d’un traitement pharmacologique antiarythmique ou ralentisseur | I | B |
| Est à considérer chez les patients avec insuffisance chronotrope et symptômes à l’effort | IIa | B |
| N’est pas indiquée dans les cas de dysfonction sinusale asymptomatique ou de cause réversible | III | C |
| Dans le cadre de bloc atrioventriculaire (BAV) : la stimulation cardiaque définitive… | Classe | Niveau de preuve |
| Est indiquée chez les patients en rythme sinusal avec BAV permanent ou paroxystique du 2e degré Mobitz II ou du 3e degré, de BAV infranodal 2:1 ou de haut degré, indépendamment des symptômes | I | C |
| Est indiquée chez les patients en arythmie atriale et BAV permanent ou paroxystique du 3e degré ou de haut degré, indépendamment des symptômes | I | C |
| Est recommandée en cas de bloc de branche alternant avec ou sans symptômes | I | C |
| Est recommandée aux patients avec BAV du 2e degré Mobitz I symptomatique ou de localisation intra ou infrahissienne à l’exploration électrophysiologique | IIa | C |
| Doit être envisagée en cas de symptômes du syndrome du pacemaker clairement attribuable à un BAV du 1er degré avec PR > 300 ms | IIa | C |
| N’est pas recommandée en cas de BAV de cause réversible | III | C |
| Dans le cadre de syncope sur troubles conductifs : la stimulation cardiaque… | Classe | Niveau de preuve |
| Est recommandée en cas de syncope récurrente sévère chez les sujets > 40 ans et : – documentation de pauses asymptomatiques > 6 secondes ou symptomatiques > 3 secondes par arrêt sinusal, bloc sinoatrial ou BAV – syndrome du sinus carotidien – syncope avec asystolie durant le test d’inclinaison |
I | A |
| Est recommandée en cas de syncope et HV ≥ 70 ms ou de BAV du 2e ou 3e degré intra ou infrahissien documenté lors de l’exploration électrophysiologique | I | B |
| Peut être proposée de 1re intention au cas par cas en cas de syncope inexpliquée et de bloc bifasciculaire chez les sujets à haut risque en cas de chute (patient âgé, fragile, syncopes récurrentes) | IIb | B |
| N’est pas recommandée chez les patients avec bloc de branche ou bloc bifasciculaire asymptomatique | III | B |
© Glikson M, Nielsen JC, Kronborg MB, Michowitz Y, Auricchio A, Barbash IM, et al. ; ESC Scientific Document Group. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021 ; 42 (35) : 3427-520.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
• En cas de dysfonction sinusale ou de BAV, il faut implanter un stimulateur double chambre. En cas de bradyarythmie, c’est-à-dire de BAV sur FA permanente, on implante un stimulateur simple chambre VVI. En cas de BAV chez les patients ayant une fraction d’éjection basse < 40 %, il faut proposer un stimulateur biventriculaire avec resynchronisation (cf. fig. 14.7).
Fig. 14.7 ![]() Types de stimulateur cardiaque en fonction du type de trouble conductif (FEVG basse).
Types de stimulateur cardiaque en fonction du type de trouble conductif (FEVG basse).
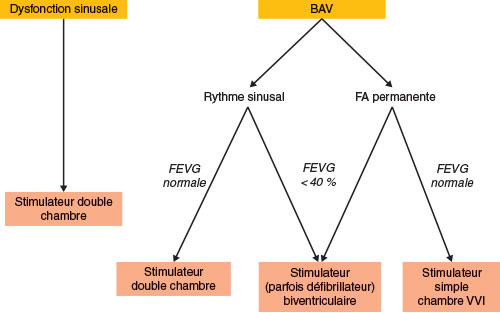
BAV : bloc atrioventriculaire ; FA : fibrillation atriale ; FEVG : fraction d’éjection du ventricule gauche.
D Traitement des blocs de branche
• ![]() La plupart des blocs de branche sont acquis et non réversibles (dégénératif ou lié à une cardiopathie). Il faut néanmoins, en fonction du contexte clinique, rechercher une éventuelle cause ou facteur aggravant (hyperkaliémie ou médicament à stopper).
La plupart des blocs de branche sont acquis et non réversibles (dégénératif ou lié à une cardiopathie). Il faut néanmoins, en fonction du contexte clinique, rechercher une éventuelle cause ou facteur aggravant (hyperkaliémie ou médicament à stopper).
• Ils ne nécessitent en général pas de traitement spécifique. En cas de syncope associée à la présence de troubles de conduction infrahissiens sur l’EEP avec mesure du HV ≥ 70 ms, il existe une indication à la mise en place d’un stimulateur cardiaque. Si l’EEP est normale, on peut proposer au patient la mise en place d’un moniteur implantable pour Holter de longue durée, à la recherche de BAV de haut degré paroxystique.
• La constatation d’un bloc de branche gauche ≥ 130 ms chez l’insuffisant cardiaque doit faire discuter une resynchronisation par stimulateur (ou défibrillateur selon les cas) biventriculaire si la FEVG est ≤ 35 % (cf. chapitre 18).
• Le bloc de branche alternant est considéré comme un équivalent de BAV de haut degré et nécessite un appareillage.
• En l’absence d’indication de stimulateur, on doit faire une surveillance clinique et ECG car l’atteinte du tissu de conduction peut être évolutive sauf dans le BBD sur cœur sain.
E Éducation et surveillance du patient appareillé d’un stimulateur
• Après implantation du stimulateur, on réalise une radiographie de thorax pour vérifier la position des sondes et on contrôle les paramètres du stimulateur à l’aide d’un programmateur dédié. Un suivi à 1–3 mois puis en général annuel est recommandé au sein du centre implanteur pour une vérification télémétrique des paramètres du système (usure de la pile, intégrité des sondes), consultation des mémoires embarquées et modification de la programmation si besoin.
• Il faut informer le patient :
– avec la remise d’un carnet comportant les caractéristiques techniques de la prothèse ;
– des interférences possibles avec les champs électromagnétiques de forte puissance (liste à remettre au patient) ;
– de la nécessité de surveiller l’état cutané et la présence de douleur ou de signes locaux au niveau du boîtier, et de consulter en cas de signes locaux (rougeur, écoulement), de fièvre inexpliquée ou d’infections respiratoires à répétition ;
– des contrôles annuels à prévoir au centre d’implantation pour vérifier le fonctionnement du stimulateur avec ECG (± test à l’aimant) et contrôle télémétrique du dispositif ;
– de la possibilité de télésurveillance en complément des consultations présentielles ;
– des modalités de réalisation des examens IRM ;
– de la nécessité de changer le boîtier en cas d’usure de la batterie (tous les 8 à 12 ans environ).
• La contre-indication absolue à l’IRM est en cours de disparition car la plupart des dispositifs récents sont compatibles avec cette technique sous réserve d’un réglage particulier de la prothèse en mode IRM à effectuer avant l’examen (dispositifs IRM-conditionnels). La prothèse est à reprogrammer après l’examen IRM (sauf pour certains modèles).
Item 17. Télémédecine, télésanté et téléservices en santé
![]() Des dispositifs de télésurveillance des prothèses cardiaques électroniques implantables (stimulateurs cardiaques, défibrillateurs, moniteurs cardiaques implantables) peuvent être installés à domicile afin de transmettre automatiquement les éléments pertinents relatifs au fonctionnement du dispositif à l’équipe médicale dont relève le patient. Cette technologie évite des déplacements inutiles et permet de réagir plus rapidement en cas de dysfonctionnement ou de trouble du rythme. Ce dispositif de télémédecine permet de programmer des téléconsultations de suivi et surtout de recevoir des téléalertes en cas de dysfonctionnement ou d’évènement rythmique enregistré. Tous les dispositifs récents sont aujourd’hui équipés de la possibilité de télétransmettre, les télétransmissions étant manuelles (par le patient) ou automatiques en cas de télésuivi programmé ou d’alerte.
Des dispositifs de télésurveillance des prothèses cardiaques électroniques implantables (stimulateurs cardiaques, défibrillateurs, moniteurs cardiaques implantables) peuvent être installés à domicile afin de transmettre automatiquement les éléments pertinents relatifs au fonctionnement du dispositif à l’équipe médicale dont relève le patient. Cette technologie évite des déplacements inutiles et permet de réagir plus rapidement en cas de dysfonctionnement ou de trouble du rythme. Ce dispositif de télémédecine permet de programmer des téléconsultations de suivi et surtout de recevoir des téléalertes en cas de dysfonctionnement ou d’évènement rythmique enregistré. Tous les dispositifs récents sont aujourd’hui équipés de la possibilité de télétransmettre, les télétransmissions étant manuelles (par le patient) ou automatiques en cas de télésuivi programmé ou d’alerte.
Points-clés
| • Les troubles de la conduction appartiennent à trois cadres nosologiques : la dysfonction sinusale, les blocs atrioventriculaires et les blocs de branche. • Les troubles de conduction peuvent être des marqueurs de la présence d’une cardiopathie, c’est surtout le cas du BBG. • Une bradycardie prolongée s’accompagne d’un rythme d’échappement situé en aval de la zone lésée : NAV en cas de DS, faisceau de His en cas de BAV nodal, etc. • Plus la lésion est distale dans le tissu de conduction, plus le rythme d’échappement est instable et lent, et donc plus le tableau est grave. • Le diagnostic ECG est obligatoire : DS : attention, pas d’onde P bloquée ; BAV : classification en 3 degrés, et le 2e degré en plusieurs types, attention le bloc 2:1 est inclassable en Mobitz I ou II. La largeur du QRS et la fréquence donnent le siège du bloc en cas de BAV complet. • L’hémibloc antérieur gauche est fréquent, l’hémibloc postérieur gauche est plus rare et plus grave. • Parmi les causes aiguës, on retient la gravité de l’infarctus du myocarde, des effets indésirables des médicaments et de l’hyperkaliémie. En revanche, les causes neurovégétatives sont bénignes. • Parmi les causes chroniques, la plus fréquente est la dégénérescence fibreuse du tissu de conduction liée à l’âge. • L’examen complémentaire de référence est : l’enregistrement selon la méthode de Holter pour la DS ; l’étude électrophysiologique endocavitaire pour le diagnostic de certitude des blocs infrahissiens ou hissiens ou en cas de syncope en présence de bloc de branche. • La prise en charge dépend bien sûr du type de trouble conductif, du contexte clinique et de la tolérance. Il faut évaluer la tolérance de la bradycardie en évaluant la tolérance hémodynamique. Une bradycardie est mal tolérée en cas angor, d’insuffisance cardiaque, d’hypotension artérielle, état de choc de syncope, ou de signes neurologiques ou aux décours d’une torsade de pointes. • Les bradycardies à risque vital nécessitant une hospitalisation urgente sont les BAV3, les BAV2 Mobitz II, les BAV de haut degré, les blocs alternants, les BSA du 3e degré et les syncopes avec troubles conductifs à l’ECG. La bradycardie est toujours plus grave en cas de BAV complet qu’en cas de DS. • On doit toujours traiter la cause si elle existe : infarctus par exemple ou arrêt de prescription d’un médicament responsable, correction d’une hyperkaliémie. • En urgence, on peut traiter par atropine ou isoprénaline, ou par la stimulation cardiaque temporaire. • La DS ne relève de l’implantation d’un stimulateur que lorsqu’elle est symptomatique et en l’absence de cause réversible. • Les BAV2 du 2e degré Mobitz II, du 3e degré ou de haut degré nécessitent la mise en place d’un stimulateur en l’absence de cause curable ou réversible. |
Notions indispensables et inacceptables
Notions indispensables
• Ne pas oublier l’ECG.
• Pour les blocs de branche : ne pas s’attarder sur les blocs incomplets de faible valeur clinique, considérer les blocs complets.
• Association fréquente de la DS à la FA dans le cadre de la maladie de l’oreillette.
Notions inacceptables
• Oublier de rechercher une cause curable devant un trouble de conduction.
• Ne pas rechercher de cardiopathie sous-jacente devant la découverte d’un BBG.
• Méconnaître la conduite à tenir en urgence devant une bradycardie.
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

CARDIOLOGIE PÉDIATRIQUE Mitral annular disjunction distance is associated with adverse outcomes in children and [...]

LA FRANCE À L’HONNEUR Aspirin in Patients with Chronic Coronary Syndrome Receiving Oral Anticoagulation [...]


