Suivez-nous sur les réseaux sociaux !
Sommaire du chapitre :
- I Définition
- II Rappel anatomique
- III Physiopathologie et conséquences hémodynamiques
- IV Étiologies
- V Aspects cliniques
- VI Examens complémentaires
- VII Évolution et complications
- VIII Traitement
- I Définition
- II Rappel anatomique et mécanismes de la fuite
- III Physiopathologie
- IV Étiologies
- V Causes des insuffisances mitrales aiguës
- VI Clinique
- VII Examens complémentaires
- VIII Évolution naturelle et complications
- IX Traitement
- I Définition
- II Rappel anatomique
- III Physiopathologie
- IV Étiologies (cf. tableau 8.2)
- V Clinique
- VI Examens complémentaires
- VII Diagnostic différentiel
- VIII Évolution et complications
- IX Surveillance
- X Traitement
Dernières publications
Publications
Chapitre 08 – Item 233 : Valvulopathies
Situations de départ
18 Découverte d’anomalies à l’auscultation cardiaque.
20 Découverte d’anomalies à l’auscultation pulmonaire.
21 Asthénie.
22 Diminution de la diurèse.
44 Hyperthermie/fièvre.
50 Malaise/perte de connaissance.
160 Détresse respiratoire aiguë.
161 Douleur thoracique.
162 Dyspnée.
165 Palpitations.
166 Tachycardie.
178 Demande/prescription raisonnée et choix d’un examen diagnostique.
185 Réalisation et interprétation d’un électrocardiogramme (ECG).
190 Hémoculture positive.
203 Élévation de la protéine C-réactive (CRP).
230 Rédaction de la demande d’un examen d’imagerie.
231 Demande d’un examen d’imagerie.
232 Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie.
233 Identifier/reconnaître les différents examens d’imagerie (type/fenêtre/séquences/incidences/injection).
239 Explication préopératoire et recueil de consentement d’un geste invasif diagnostique ou thérapeutique.
247 Prescription d’une rééducation.
248 Prescription et suivi d’un traitement par anticoagulant et/ou antiagrégant.
253 Prescrire des diurétiques.
255 Prescrire un anti-infectieux.
258 Prévention de la douleur liée aux soins.
259 Évaluation et prise en charge de la douleur aiguë.
271 Prescription et surveillance d’une voie d’abord vasculaire.
279 Consultation de suivi d’une pathologie chronique.
285 Consultation de suivi éducation thérapeutique d’un patient avec antécédents cardiovasculaires.
300 Consultation pré-anesthésique.
311 Prévention des infections liées aux soins.
314 Prévention des risques liés au tabac.
320 Prévention des maladies cardiovasculaires.
324 Modification thérapeutique du mode de vie (sommeil, activité physique, alimentation, etc.).
328 Annonce d’une maladie chronique.
334 Demande de traitement et investigation inappropriés.
335 Évaluation de l’aptitude au sport et rédaction d’un certificat de non-contre-indication.
339 Prescrire un arrêt de travail.
342 Rédaction d’une ordonnance/d’un courrier médical.
352 Expliquer un traitement au patient (adulte/enfant/adolescent).
354 Évaluation de l’observance thérapeutique.
355 Organisation de la sortie d’hospitalisation.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé | Descriptif |
|---|---|---|---|
| Définition | Définition de l’insuffisance mitrale (IM), du rétrécissement aortique (RA), de l’insuffisance aortique (IA), du rétrécissement mitral (RM) | ||
| Étiologies | Connaître les principales étiologies des valvulopathies (IM, RA, IA, RM) | ||
| Diagnostic positif | Signes fonctionnels et examen clinique (auscultation) de l’IM, RA, IA, RM | ||
| Examens complémentaires | Connaître la valeur primordiale de l’échocardiographie dans l’IM, l’IA, le RA et le RM | Diagnostic positif, diagnostic du mécanisme et de l’étiologie, diagnostic de sévérité | |
| Physiopathologie | Mécanismes et conséquences physiopathologiques de l’IM, l’IA, du RA, du RM | ||
| Examens complémentaires | Connaître l’intérêt de l’ECG, de la radiographie thoracique, de l’épreuve d’effort dans les valvulopathies | ||
| Suivi et/ou pronostic | Évolutions et complications de l’IM, du RA, de l’IA, du RM | ||
| Prise en charge | Principes du traitement chirurgical de l’IM, du RA, de l’IA, du RM | Plastie ou remplacement valvulaire | |
| Prise en charge | Principe des traitements percutanés de l’IM, du RA, du RM | TAVI, savoir que cette Alternative percutanée existe pour l’IM (Mitraclip®) | |
| Prise en charge | Principales indications de traitement chirurgical de l’IM, du RA, du RM et de l’IA | ||
| Prise en charge | Principales indications de traitement percutané du RA et de l’IM | ||
| Prise en charge | Modalités du traitement médical de l’IA | Bêtabloquant dans le Marfan | |
Rétrécissement aortique
I. Définition
II. Rappel anatomique
III. Physiopathologie et conséquences hémodynamiques
IV. Étiologies
V. Aspects cliniques
VI. Examens complémentaires
VII. Évolution et complications
VIII. Traitement
I Définition
![]() Le rétrécissement aortique (RA) est la valvulopathie la plus fréquente : il est défini comme un obstacle à l’éjection du ventricule gauche localisé le plus souvent au niveau de la valve aortique.
Le rétrécissement aortique (RA) est la valvulopathie la plus fréquente : il est défini comme un obstacle à l’éjection du ventricule gauche localisé le plus souvent au niveau de la valve aortique.
L’étiologie la plus fréquente est le RA dégénératif du sujet âgé de plus de 65 ans.
Il existe d’autres formes d’obstacle à l’éjection du ventricule gauche qui se localisent en aval ou en amont de la valve aortique, non abordées ici :
• rétrécissement supra-aortique ;
• rétrécissement sous-aortique (diaphragme) ;
• obstruction dynamique des cardiomyopathies obstructives.
II Rappel anatomique
La valve aortique est normalement constituée de trois feuillets valvulaires (elle est dite tricuspide) également appelés cusps ou sigmoïdes : 1 cusp antéro-droite en regard du sinus aortique (ou sinus de Valsalva) antéro-droit, 1 cusp antéro-gauche en regard du sinus antéro-gauche, et 1 cusp non coronaire. Les 3 cusps s’ouvrent vers l’aorte au cours de l’éjection ventriculaire de manière passive suivant le gradient de pression ventriculo-aortique.
Avec le vieillissement et au cours de différents processus physiopathologiques, les cusps peuvent s’épaissir, devenir plus rigides et/ou se calcifier, ce qui aboutit à restreindre leur mobilité.
Chez 1–2 % de la population générale, la valve aortique est constituée de seulement 2 cusps, en général par fusion ou défaut de séparation embryologique de 2 cusps. Il s’agit d’une anomalie congénitale, qui apparaît lors du développement fœtal. On parle de bicuspidie aortique. La bicuspidie aortique favorise la survenue d’un RA.
III Physiopathologie et conséquences hémodynamiques
![]() La diminution de la surface de l’orifice aortique réalise une résistance à l’éjection ventriculaire entraînant plusieurs conséquences : gradient de pression ventriculo-aortique, hypertrophie pariétale et dysfonction diastolique.
La diminution de la surface de l’orifice aortique réalise une résistance à l’éjection ventriculaire entraînant plusieurs conséquences : gradient de pression ventriculo-aortique, hypertrophie pariétale et dysfonction diastolique.
Le ventricule gauche s’hypertrophie, s’épaissit de manière concentrique car il doit, à chaque systole, pousser plus fort que normalement sur la valve aortique qui constitue un obstacle à l’éjection.
A Gradient de pression ventriculo-aortique
En l’absence de RA, le gradient de pression est extrêmement faible entre ventricule gauche et aorte pendant l’éjection (2 à 5 mmHg), les courbes de pressions ventriculaire gauche (PVG) et aortique (PAo) sont pratiquement superposables.
En présence d’un obstacle à l’éjection ventriculaire, apparaît une hyperpression intraventriculaire gauche (cf. fig. 8.1) avec gradient de pression ventriculo-aortique (PVG > PAo).
Le gradient de pression VG – aorte est d’autant plus élevé que le rétrécissement aortique est serré. Lorsque le gradient moyen de pression VG – aorte atteint 40 mmHg, le RA est considéré comme serré.
Fig. 8.1 ![]() Exemple d’enregistrement par cathétérisme des pressions dans l’aorte et dans le ventricule gauche chez un patient ayant un gradient en rapport avec un rétrécissement valvulaire aortique
Exemple d’enregistrement par cathétérisme des pressions dans l’aorte et dans le ventricule gauche chez un patient ayant un gradient en rapport avec un rétrécissement valvulaire aortique
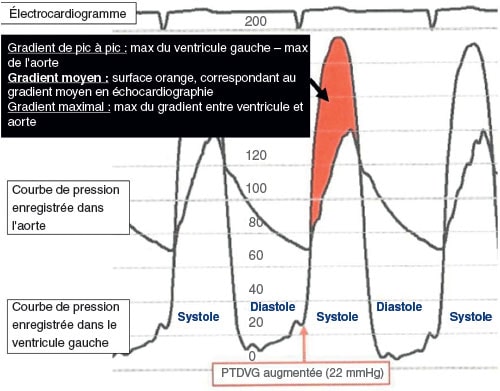
PTDVG : pression télédiastolique du ventricule gauche.
B Hypertrophie pariétale
L’augmentation de pression intraventriculaire gauche entraîne dans un premier temps une augmentation des contraintes pariétales ou postcharge. Selon la loi de Laplace : Contrainte = Pression x Diamètre de la cavité / Épaisseur pariétale
Si les contraintes pariétales restent élevées, on assiste à une diminution de la performance systolique du ventricule gauche puisque les contraintes pariétales s’opposent physiologiquement au déplacement des parois du ventricule.
| En pratique |
En effet, l’augmentation des contraintes pariétales est un puissant stimulant de la réplication des cellules myocardiques aboutissant à une hypertrophie pariétale (épaississement des parois) ; cette hypertrophie pariétale concentrique finit, à son tour, par compenser l’élévation de pression intraventriculaire et normaliser les contraintes pariétales (cf. loi de Laplace), ce qui permet finalement de maintenir normale la performance systolique ventriculaire globale (évaluée, par exemple, par la mesure de la fraction d’éjection).
Au début, la performance systolique globale du VG est le plus souvent préservée chez un patient atteint de RA. Cependant chez certains patients, l’hypertrophie pariétale n’est pas suffisante pour normaliser les contraintes pariétales, d’où une diminution de la performance systolique globale (baisse de la fraction d’éjection) et l’apparition de signes d’insuffisance cardiaque. De plus, l’hypertrophie peut s’accompagner de fibrose intramyocardique là où la contrainte est la plus forte et dans ce cas, la levée de l’obstacle peut ne pas permettre une récupération ad integrum de la fonction ventriculaire gauche en postopératoire.
L’hypertrophie pariétale peut en effet s’accompagner d’une inadéquation entre les apports et les besoins : les artères coronaires n’étant pas capables « d’irriguer », l’ensemble des myocytes d’un myocarde hypertrophié est soumis à une forte tension pariétale (due à la sténose). Il existe alors une ischémie myocardique favorisant la fibrose telle que sus-citée.
C Dysfonction diastolique
L’hypertrophie pariétale entraîne une altération de la compliance ventriculaire (élasticité) et un ralentissement de la relaxation.
Ces deux anomalies de la fonction diastolique induisent une élévation des pressions du ventricule gauche pendant la phase de remplissage (diastole). Cette augmentation de pression diastolique se transmet en amont au niveau des veines et capillaires pulmonaires avec pour conséquence un tableau d’insuffisance cardiaque (congestion pulmonaire).
La contraction de l’atrium prend alors un rôle important dans le remplissage ventriculaire et donc dans le maintien du débit cardiaque. C’est pourquoi la perte de la systole par fibrillation atriale est en général mal tolérée chez les patients atteints de RA (poussée d’insuffisance cardiaque).
IV Étiologies
A Rétrécissement valvulaire aortique congénital
![]() La bicuspidie (valve aortique comprenant 2 sigmoïdes à la place de 3) est :
La bicuspidie (valve aortique comprenant 2 sigmoïdes à la place de 3) est :
• l’étiologie la plus fréquente entre 30 et 65 ans ;
• en général bien tolérée pendant l’enfance et l’adolescence. C’est une malformation « évolutive » qui finit par entraîner un rétrécissement aortique à l’âge adulte.
Il est important de retenir que la valve bicuspide est souvent associée à un anévrisme de l’aorte ascendante qu’il faut savoir rechercher, au même titre qu’une coarctation (beaucoup plus rare).
Il faut savoir dépister une bicuspidie dans les familles où cette anomalie a été détectée.
La bicuspidie est multiple : certaines formes sont responsables d’une insuffisance aortique et d’autres d’un rétrécissement valvulaire aortique. La forme la plus fréquente est la bicuspidie dite de type I avec raphé : fusion entre les sigmoïdes antéro-gauche et antéro-droite.
B Rétrécissement aortique acquis
1 Dégénératif ou maladie de Mönckeberg
• C’est la forme de loin la plus fréquente de rétrécissement aortique chez le patient âgé (> 65–70 ans).
| La prévalence du rétrécissement valvulaire aortique dégénératif augmente avec l’âge et de fait, constitue de loin la cause la plus fréquente de rétrécissement valvulaire aortique. |
• Il est caractérisé par un dépôt de calcifications à la base des valvules qui deviennent rigides. La valve est ainsi très calcifiée, d’autant plus que la sténose est sévère.
• À noter que la physiopathologie de cette forme de RA est proche de celle conduisant à l’athérosclérose sur la paroi des artères.
2 Post-rhumatismal
Cette étiologie est devenue rare, mais on la rencontre encore en particulier chez les migrants. En général, le RA est associé à une IA et à une atteinte mitrale (RM + IM).
| Les étiologies du rétrécissement aortique peuvent être résumées ainsi : • bicuspidie dans la majorité des cas avant 65–70 ans ; • dégénératif dans la majorité des cas après cet âge. |
V Aspects cliniques
A Circonstances de découverte
Il s’agit de :
• souffle entendu lors d’une consultation ;
• symptômes (cf. infra) ;
• complication : insuffisance cardiaque ;
• échocardiographie réalisée pour une autre cause (plus rare).
B Signes fonctionnels
Longtemps asymptomatique, le RA peut se manifester par :
• une dyspnée d’effort ;
• un angor d’effort ;
• une syncope d’effort.
L’apparition des symptômes en présence d’un RA serré est précédée d’une longue période asymptomatique qui peut durer plusieurs années.
L’interrogatoire est fondamental : le patient présente des symptômes à l’effort. Mais il peut avoir limité ses efforts pour ne pas avoir de symptôme et se dire asymptomatique parce qu’au repos, il est asymptomatique. Il faut donc rechercher minutieusement les efforts où le patient est anormalement limité !
| L’angor d’effort, la syncope d’effort et la dyspnée d’effort sont les trois maîtres symptômes du rétrécissement aortique et s’accompagnent d’un mauvais pronostic en l’absence de traitement. |
C Examen et auscultation
1 Palpation
Elle retrouve :
• un frémissement palpatoire : perçu avec le plat de la main, au foyer aortique, le patient étant en fin d’expiration penché en avant. En général, il traduit la présence d’un rétrécissement aortique hémodynamiquement significatif ;
• dans les cas évolués : un élargissement du choc de pointe qui est dévié en bas et à gauche, signant la dilatation du ventricule gauche.
2 Auscultation
En général typique, elle permet de faire le diagnostic, avec :
• souffle mésosystolique, éjectionnel, intense, rude, râpeux, maximum au 2e espace intercostal droit, irradiant dans les vaisseaux du cou (cf. fig. 8.2), tonalité parfois plus musicale au foyer pulmonaire ou à la pointe, il se renforce après une diastole longue. Il peut être associé à un souffle d’insuffisance aortique (on parle de maladie aortique) ;
• abolition de B2 dans les RA serrés calcifiés.
Dans le rétrécissement aortique évolué avec bas débit, le souffle peut devenir moins intense, voire quasiment inaudible.
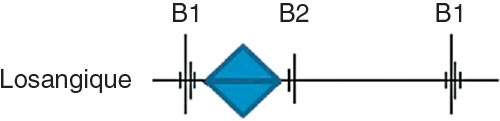
Fig. 8.2 ![]() Souffle losangique, maximal en mésosystole du rétrécissement valvulaire aortique.
Souffle losangique, maximal en mésosystole du rétrécissement valvulaire aortique.
Ce souffle irradie vers les carotides.
VI Examens complémentaires
A Radiographie thoracique
![]() Elle peut être strictement normale ou objectiver :
Elle peut être strictement normale ou objectiver :
• une dilatation du VG en cas de RA évolué avec cardiomégalie ;
• une surcharge pulmonaire en cas de RA évolué avec insuffisance cardiaque gauche.
B Électrocardiogramme
Il peut être normal en cas de rétrécissement aortique peu évolué.
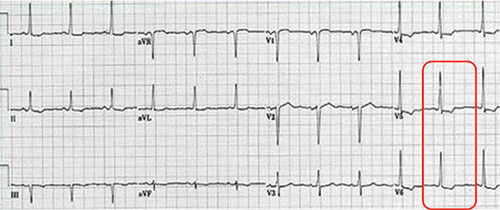
Le plus souvent, l’ECG est anormal dans les rétrécissements aortiques serrés avec :
• hypertrophie ventriculaire gauche de type surcharge systolique (cf. fig. 8.3). Cependant, l’absence d’HVG électrique n’exclut pas le diagnostic de RA serré. En effet chez l’adulte, la corrélation entre caractère serré du RA et HVG dépistée à l’ECG est loin d’être excellente ;
• hypertrophie atriale gauche ;
• troubles de conduction (BBG, BAV du 1er degré) ;
• troubles du rythme, en particulier fibrillation atriale plutôt en cas de RA évolué, moins fréquemment que dans les valvulopathies mitrales cependant.
Fig. 8.3 ![]() Hypertrophie ventriculaire gauche avec surcharge dite systolique (T négatives et asymétriques dans les précordiales gauches).
Hypertrophie ventriculaire gauche avec surcharge dite systolique (T négatives et asymétriques dans les précordiales gauches).
C Échocardiographie doppler transthoracique (ETT)
![]() C’est l’examen clé de l’exploration du RA comme de l’exploration de toute valvulopathie. Il permet de :
C’est l’examen clé de l’exploration du RA comme de l’exploration de toute valvulopathie. Il permet de :
• confirmer le diagnostic de RA ;
• quantifier le degré de sévérité ;
• apprécier le retentissement ventriculaire et hémodynamique ;
• éliminer une autre atteinte valvulaire associée (mitrale).
1 Confirmer le diagnostic
• En échographie 2D, la valve aortique est remaniée, calcifiée avec une ouverture des sigmoïdes diminuée (cf. fig. 8.4).
• En doppler continu, les vitesses du sang à travers la valve aortique sont augmentées (> 2,5 m/s).
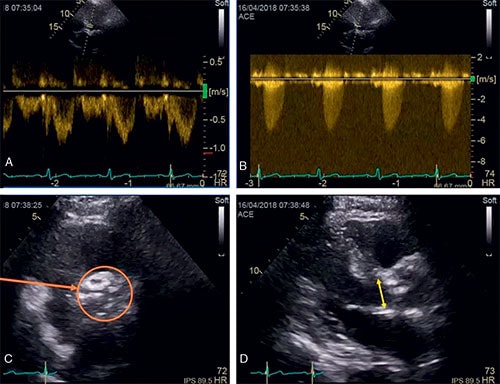
A. Enregistrement en doppler pulsé du flux en amont de la valve aortique, c’est-à-dire en amont de l’accélération des flux, liée à la sténose aortique. Reflet du débit cardiaque. B. Enregistrement en doppler continu de la vitesse maximale au travers de la valve sténosée. De cette mesure de vitesse, on extrait les gradients maximal et moyen (intégration des vitesses maximales tout au long de la systole). C. Vue petite axe avec, au centre, la valve aortique tricuspide très remaniée et calcifiée. D. En long axe, idem + incidence permettant la mesure du diamètre de la chambre de l’anneau utile au calcul de la surface dite fonctionnelle de la valve aortique sténosée.
2 Quantifier le degré de sévérité
• Par la mesure de la vitesse maximale (Vmax) (cf. fig. 8.4) du sang à travers l’orifice aortique en doppler continu (qui est augmentée du fait de la réduction de l’orifice) : une Vmax > 4 m/s est en général associé à un RA serré (elle est normalement de l’ordre de 1 m/s). Mais elle est dépendante du débit.
• Par le calcul du gradient de pression VG – aorte à partir de l’enregistrement en doppler continu des vitesses du flux transaortique. Un gradient moyen calculé en doppler > 40 mmHg correspond en général à un rétrécissement aortique serré.
À noter cependant qu’un rétrécissement aortique serré peut s’accompagner d’un gradient de pression faible en cas de bas débit. Par conséquent, la seule mesure du gradient de pression peut ne pas suffire pour évaluer la sévérité d’un RA. On la complète par la mesure de la surface aortique.
• Par la mesure de la surface valvulaire aortique à l’aide du doppler. La surface orificielle d’une valve aortique normale est de 2 à 3,5 cm2. En cas de RA, cette surface diminue. On parle de RA serré pour une surface < 1 cm2 ou < 0,60 cm2/m2 de surface corporelle, et critique si la surface est ≤ 0,75 cm2 ou ≤ 0,4 cm2/m2 de surface corporelle. La surface valvulaire peut parfois s’apprécier directement par planimétrie en bidimensionnel en ETT ou, mieux, en ETO, qui n’est donc réservée qu’à de rares patients.
| Critères de RA serré • Vmax > 4 m/s • Gradient moyen > 40 mmHg • Surface aortique < 1 cm2 ou < 0,6 cm2/m2 |
| Important Le RA peut être serré malgré un gradient moyen VG – aorte < 40 mmHg. Dans ce cas, le débit cardiaque est altéré, et le volume d’éjection systolique est ≤ 35 mL/m2, que la FEVG soit préservée ou altérée. Pour être certain du caractère serré du RA, on peut effectuer une échocardiographie sous faible dose de dobutamine pour augmenter le débit et confirmer le caractère serré du RA. Si sous dobutamine, la surface dépasse 1 cm2, on parle de pseudo-sténose valvulaire aortique qu’il faut surveiller et traiter comme une insuffisance cardiaque avec les médicaments appropriés. |
3 Apprécier les signes de retentissement indirect
L’ETT peut évaluer les conséquences du RA au niveau :
• du ventricule gauche :
– degré d’hypertrophie du VG,
– dilatation du VG,
– altération de la FEVG.
![]() Même asymptomatique, il peut être discuté un remplacement valvulaire aortique si la FEVG est ≤ 55 % si le rétrécissement valvulaire aortique est la seule cause de la « relative » dégradation de la FEVG. Cette mesure de la FEVG peut-être complétée de la mesure des déformations (strain) mais aussi de la recherche de fibrose en IRM si un doute sur l’indication opératoire et sur le retentissement de la valvulopathie existe ;
Même asymptomatique, il peut être discuté un remplacement valvulaire aortique si la FEVG est ≤ 55 % si le rétrécissement valvulaire aortique est la seule cause de la « relative » dégradation de la FEVG. Cette mesure de la FEVG peut-être complétée de la mesure des déformations (strain) mais aussi de la recherche de fibrose en IRM si un doute sur l’indication opératoire et sur le retentissement de la valvulopathie existe ;
• ![]() du débit cardiaque : pendant longtemps le débit cardiaque au repos reste conservé dans le RA. Mais dans le RA serré, évolué avec atteinte de la fonction ventriculaire, le débit peut s’abaisser ;
du débit cardiaque : pendant longtemps le débit cardiaque au repos reste conservé dans le RA. Mais dans le RA serré, évolué avec atteinte de la fonction ventriculaire, le débit peut s’abaisser ;
• de la pression artérielle pulmonaire (PAP) : en général elle reste longtemps normale en cas de RA. Ce n’est que dans le RA évolué avec altération de la fonction ventriculaire gauche que la PAP s’élève.
4 Éliminer une autre atteinte valvulaire et mesurer la taille de l’aorte
Il peut s’agir d’une atteinte :
• de la valve mitrale principalement ;
• du cœur droit et de la valve tricuspide : la dysfonction diastolique peut s’associer à une augmentation chronique des pressions pulmonaires. Celle-ci constituant un obstacle à l’éjection du ventricule droit peut en favoriser la dilatation et de fait, l’insuffisance tricuspidienne fonctionnelle.
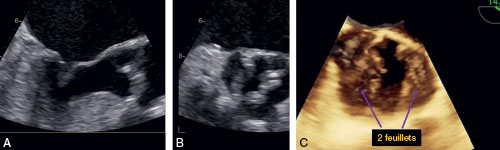
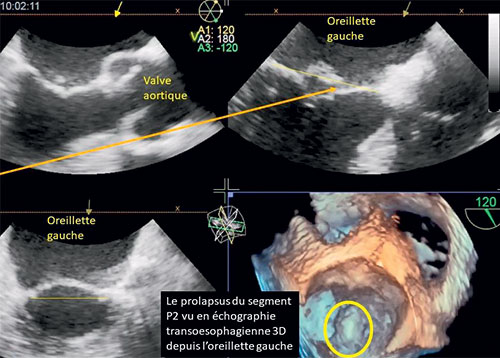
La taille de l’aorte est importante à évaluer notamment en cas de bicuspidie (cf. fig. 8.5) dans le bilan préopératoire pour savoir si un geste associé sur l’aorte peut être nécessaire. Dans ce cas, une échocardiographie transœsophagienne peut être utile pour confirmer la bicuspidie et mieux évaluer la taille de l’aorte.
Fig. 8.5 ![]() Valve aortique bicuspide en vue transœsophagienne bidimensionnelle (A, B) et tridimensionnelle (C).
Valve aortique bicuspide en vue transœsophagienne bidimensionnelle (A, B) et tridimensionnelle (C).
D Cathétérisme et coronarographie
La plupart des renseignements autrefois apportés par le cathétérisme peuvent être obtenus aujourd’hui par échocardiographie doppler. Il s’agit des mêmes paramètres : gradient de pression VG – aorte, surface valvulaire, fonction VG et mesure du débit cardiaque.
| Le cathétérisme n’est donc habituellement pas réalisé. |
Les seules indications qui restent du cathétérisme sont les rares cas de discordance entre la clinique et les données de l’échocardiographie doppler. Ces cas correspondent souvent à ceux des patients peu échogènes.
En revanche, il faut éliminer une atteinte coronarienne par la coronarographie en préopératoire :
• si l’âge est > 40 ans chez l’homme et chez la femme ménopausée sans facteur de risque ;
• en cas de facteurs de risque coronarien (personnels ou familiaux) ou si le patient se plaint d’angor d’effort ou de signes d’insuffisance cardiaque, quel que soit l’âge. En effet, l’angor peut s’observer dans le RA en l’absence de toute atteinte coronarienne, mais la distinction entre angor fonctionnel et angor lié à une coronaropathie est impossible à faire cliniquement.
| Place du scanner coronarien (coroscanner) et cardiaque • La place du coroscanner en remplacement de la coronarographie préopératoire reste controversée, chez des patients souvent âgés dont la prévalence des calcifications coronariennes, qui gênent l’interprétation du scanner, est importante. • Le scanner cardiaque trouve en revanche toute sa place dans le bilan préopératoire lorsque l’on s’oriente vers un remplacement valvulaire percutané (TAVI : Trans Aortic Valve Implantation) afin de bien mesurer la taille de l’anneau aortique qui permet de choisir la taille appropriée de la prothèse et d’analyser l’arbre artériel (iliofémoral, subclavier ou carotidien) pour discuter la voie d’abord. • Le scanner permet également d’apprécier la taille de l’aorte lorsque l’ETT n’a pas permis de donner une évaluation suffisante. • |
E Épreuve d’effort
![]() L’épreuve d’effort est préconisée dans le RA serré asymptomatique pour justement vérifier de manière objective son caractère asymptomatique. En effet, certains patients sous-estiment leurs symptômes car ils se sont adaptés et ne font pratiquement pas d’effort. L’épreuve d’effort s’attache à évaluer le niveau d’effort atteint et surtout une augmentation inadéquate ou une baisse de la pression artérielle au cours de l’effort.
L’épreuve d’effort est préconisée dans le RA serré asymptomatique pour justement vérifier de manière objective son caractère asymptomatique. En effet, certains patients sous-estiment leurs symptômes car ils se sont adaptés et ne font pratiquement pas d’effort. L’épreuve d’effort s’attache à évaluer le niveau d’effort atteint et surtout une augmentation inadéquate ou une baisse de la pression artérielle au cours de l’effort.
| Attention |
VII Évolution et complications
Le RA peut rester longtemps asymptomatique. L’apparition de symptômes, a fortiori de complications, est importante à prendre en compte car elle est associée à un mauvais pronostic en l’absence de traitement spécifique et en pratique doit faire poser une indication de traitement. Les complications possibles sont les suivantes :
• insuffisance cardiaque ;
• fibrillation atriale, en général mal tolérée (car perte de la systole atriale, cf. III. Physiopathologie et conséquences hémodynamiques) ;
• troubles de la conduction ;
• mort subite : surtout dans le RA serré symptomatique ;
• endocardite (rare) ;
• hyperexcitabilité ventriculaire (rare) ;
• embolies calcaires systémiques (rares) pouvant intéresser le cerveau, le rein, les coronaires et l’artère centrale de la rétine (responsables de pertes transitoires de la vision) ;
• anémie ferriprive par hémorragie digestive secondaire à des angiodysplasies intestinales pouvant être associées à une anomalie acquise du facteur Von Willebrand (syndrome de Heyde).
VIII Traitement
A Possibilités thérapeutiques
1 Remplacement valvulaire chirurgical
Prothèse mécanique
• Elle impose un traitement anticoagulant à vie.
• Elle est caractérisée par une longue durée de vie.
• Elle est indiquée si le sujet est jeune.
Prothèse biologique
• Elle évite le traitement anticoagulant.
• Elle est indiquée si le patient est âgé de plus de 65 ans.
• Il existe un risque de dégénérescence dans les 10–15 ans.
2 Implantation percutanée d’une valve aortique (TAVI : Trans Aortic Valve Implantation)
Il s’agit de l’implantation par voie percutanée (voie fémorale ou apicale) d’une valve aortique biologique chez les patients atteints de RA pour lesquels le risque chirurgical est jugé élevé ou intermédiaire, alors qu’on peut espérer un gain fonctionnel du patient s’il est possible de corriger le rétrécissement valvulaire aortique. L’indication de valve aortique percutanée ne peut pas être portée sans l’aval d’une équipe médico-chirurgicale expérimentée et seulement après une discussion pluridisciplinaire dédiée (Heart Team). L’âge du patient, sa fragilité, ses comorbidités et ses souhaits sont les facteurs pris en compte pour choisir entre chirurgie conventionnelle et TAVI.
Cette technique est de plus en plus employée et a même dépassé en nombre les remplacements valvulaires chirurgicaux en France. Elle est désormais proposable à des patients à risque intermédiaire (≥ 75 ans).
3 Valvuloplastie percutanée
Il s’agit d’une dilatation simple du RA par un ballon situé à l’extrémité d’un cathéter introduit de manière rétrograde dans l’aorte à partir d’un point de ponction fémorale sans mise en place de prothèse.
Cette technique, qui avait précédé le TAVI, est quasiment abandonnée en raison du taux très élevé de resténose précoce.
B Indications
1 RA serré symptomatique
Tout RA serré symptomatique doit être pris en charge (remplacement valvulaire ou TAVI) compte tenu du risque vital existant et ce, pratiquement sans limite d’âge, sous réserve d’un état général conservé et de l’absence d’une autre pathologie mettant en jeu le pronostic vital à court terme.
2 RA serré asymptomatique
La surveillance est recommandée et préférée à la chirurgie si le RA est vraiment asymptomatique et s’accompagne d’une FEVG normale, sauf dans les cas suivants où la chirurgie (ou le TAVI) est tout de même recommandée :
• RA asymptomatique associé à une épreuve d’effort anormale ;
• RA asymptomatique très serré (Vmax > 5 m/s) ;
• RA asymptomatique avec aggravation rapide de la sténose lors de la surveillance ;
• RA asymptomatique avec altération de la FEVG (FEVG < 55 %).
3 Cas des RA avec dysfonction systolique ventriculaire gauche (FE < 35 %)
C’est un problème difficile car le risque opératoire est plus élevé et le pronostic est plus mauvais à long terme. Mais attention, le pronostic à long terme le plus mauvais est celui observé chez les patients non opérés !
La décision de remplacement valvulaire peut être facilitée par la réalisation d’une échocardiographie doppler de stress sous dobutamine (évaluation de la réserve de contractilité du VG) qui permet d’exclure (comme évoqué au-dessus) la pseudo-sténose (gradient < 40 mmHg et surface < 1 cm2 au repos, qui devient > 1 cm2 sous dobutamine).
C Bilan préopératoire
• ![]() Il doit permettre d’évaluer le risque opératoire.
Il doit permettre d’évaluer le risque opératoire.
• Il comporte en général :
– imagerie des coronaires (coronarographie ou coroscanner) ;
– scanner ou IRM de l’aorte en cas de dilatation aortique (bicuspidie). Le scanner peut également permettre de calculer le score calcique (cf. encadré supra) et l’IRM cardiaque permet de quantifier la fibrose de remplacement du myocarde ventriculaire gauche (pour les cas difficiles) ;
– échodoppler des troncs supra-aortiques ;
– recherche de foyers infectieux de la sphère ORL ou stomatologique avec radiographie des sinus et panoramique dentaire ;
– recherche d’autres comorbidités (fonction rénale, pathologie pulmonaire, etc.) ;
– avis gériatrique chez le sujet très âgé pour bien peser le rapport risque/bénéfice de la procédure.
Points-clés
| • Le rétrécissement aortique est la valvulopathie la plus fréquente, notamment chez le sujet âgé. • • Deux étiologies dominent : la bicuspidie aortique et le RA dégénératif ; le RAA peut se voir chez les migrants. • Le RA est souvent asymptomatique, sinon les 3 symptômes cardinaux sont : dyspnée d’effort, angor d’effort, syncope d’effort. • L’auscultation retrouve un souffle systolique éjectionnel râpeux au foyer aortique, irradiant dans les vaisseaux du cou, un B2 aboli en cas de RA serré. • • L’échocardiographie :– confirme le diagnostic de RA ;– quantifie son degré de sévérité (RA serré : Vmax > 4 m/s, gradient moyen VG-Ao > 40 mmHg, surface < 1 cm2 ou < 0,6 cm2/m2) ; – évalue la FEVG. • L’ETO présente peu d’intérêt sauf si le patient est peu échogène, pour faire la planimétrie du RA. – le remplacement valvulaire aortique chirurgical conventionnel le plus souvent par bioprothèse (sujet âgé), parfois par prothèse mécanique ; – le TAVI, encore aujourd’hui réservé aux patients dont le risque opératoire est élevé ou intermédiaire mais dont les indications s’étendront probablement dans l’avenir en fonction des résultats des études en cours et de la durabilité des prothèses. • Le traitement est indiqué en cas de RA serré avec présence de symptôme et, en l’absence de symptômes, en cas de : – RA serré et baisse de la FEVG ; – RA serré et épreuve d’effort anormale ; – RA très serré ou aggravation rapide de la sténose. • Dans les autres cas, la conduite à tenir comporte surveillance médicale et ETT. |
Notions indispensables et inacceptables
Notions indispensables
• Ne pas oublier de rechercher une atteinte coronarienne à partir d’un certain âge dans le bilan préopératoire.
• Penser à évaluer la taille de l’aorte dans la bicuspidie.
Notions inacceptables
• Oublier l’éducation thérapeutique du patient connu pour une sténose aortique concernant la prévention de l’endocardite infectieuse (groupe à risque modéré) et, le cas échéant, une consultation urgente si apparaissent des symptômes à l’effort.
• Ne pas penser à une endocardite infectieuse en cas de fièvre.
• Ne pas référer à un spécialiste un patient porteur d’une sténose valvulaire aortique symptomatique.
• Ne pas référer à un spécialiste un patient d’une sténose valvulaire avec un souffle modifié ou des symptômes nouveaux.
• Ne pas référer à un spécialiste un patient porteur d’une sténose valvulaire pour son suivi annuel.
Réflexes transversalité
• Item 152 – Endocardite infectieuse.
• Item 153 – Surveillance des porteurs de valves et prothèses vasculaires.
• Item 342 – Malaise, perte de connaissance, crise convulsive chez l’adulte.
Insuffisance mitrale
I. Définition
II. Rappel anatomique et mécanismes de la fuite
III. Physiopathologie
IV. Étiologies
V. Causes des insuffisances mitrales aiguës
VI. Clinique
VII. Examens complémentaires
VIII. Évolution naturelle et complications
IX. Traitement
I Définition
![]() L’insuffisance mitrale (IM) réalise un défaut d’étanchéité de la valve mitrale entraînant un reflux de sang du ventricule gauche vers l’atrium gauche (AG) au cours de la systole.
L’insuffisance mitrale (IM) réalise un défaut d’étanchéité de la valve mitrale entraînant un reflux de sang du ventricule gauche vers l’atrium gauche (AG) au cours de la systole.
II Rappel anatomique et mécanismes de la fuite
La valve mitrale comporte deux feuillets : un feuillet antérieur et un feuillet postérieur composé de trois segments. Les deux valves se rejoignent au niveau des commissures antéroexterne et postéro-interne. Elles s’insèrent sur l’anneau mitral fibreux. Elles sont tenues au niveau ventriculaire par des cordages, qui s’insèrent au niveau des piliers. Chaque pilier donne des cordages pour les deux valves et chaque pilier est musculaire et fait partie intégrante du myocarde ventriculaire gauche.
Lors de la systole ventriculaire, les deux valves (postérieure et antérieure) s’affrontent dans le plan de l’anneau mitral et l’orifice mitral est étanche (pas de fuite).
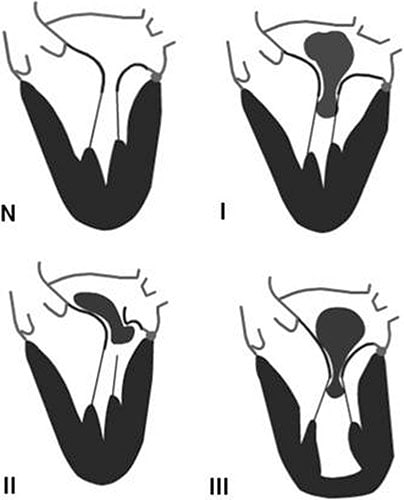
![]() La classification des IM initialement proposée par Carpentier (cf. fig. 8.6) tient compte de la position des valves lors de la systole ventriculaire :
La classification des IM initialement proposée par Carpentier (cf. fig. 8.6) tient compte de la position des valves lors de la systole ventriculaire :
• type I : les valves restent dans le plan de l’anneau lors de la systole ventriculaire et le jeu valvulaire est normal. Ce peut être le cas des perforations, fentes mais surtout des IM secondaires à la dilatation et l’aplatissement de l’anneau qui fait suite à une dilatation importante de l’oreillette gauche, comme ce peut être le cas dans les fibrillations atriales permanentes chez les sujets âgés ;
• type II : une valve au moins dépasse le plan de l’anneau lors de la systole ventriculaire. Le jeu valvulaire est exagéré : c’est typiquement le cas des IM dystrophiques avec prolapsus d’une des deux valves ou des deux dans l’atrium gauche ; la coaptation ne se fait plus dans le plan de l’anneau mais dans l’oreillette gauche ;
• type III : les valves restent au-dessus du plan de l’anneau lors de la systole ventriculaire (dans le ventricule), le jeu valvulaire est restreint :
il peut être restrictif en systole et en diastole (type IIIa) avec limitation de l’ouverture et de la fermeture de la valve : rhumatisme articulaire aigu, radiothérapie, IM médicamenteuses ;
il peut être restrictif seulement en systole (type IIIb) avec limitation uniquement de la fermeture : IM des cardiomyopathies, en particulier ischémiques (chroniques).
• l’anneau ; • les feuillets ; • les cordages ; • les piliers et leur déplacement si le ventricule devient plus sphérique, plus dilaté. |
Fig. 8.6 ![]() Classification de Carpentier : valve mitrale normale (N) et insuffisance mitrale de type I à III.
Classification de Carpentier : valve mitrale normale (N) et insuffisance mitrale de type I à III.
III Physiopathologie
La régurgitation mitrale entraîne des conséquences en amont et en aval. Le volume régurgité dépend de trois facteurs principaux :
• la taille de l’orifice régurgitant ;
• le gradient de pression entre le ventricule gauche et l’atrium gauche ;
• la durée de la systole.
Les conséquences hémodynamiques sont :
• en aval :
– surcharge volumique du VG aboutissant à une dilatation de la cavité ventriculaire gauche : en effet, le VG s’adapte car il doit faire face à une augmentation du volume diastolique, le VG éjectant, à chaque systole en plus du volume d’éjection systolique dans l’aorte, une proportion plus ou moins importante de sang dans l’atrium gauche, augmentation de l’épaisseur des parois pour lutter contre l’augmentation du stress pariétal lié à la dilatation, aboutissant à une hypertrophie excentrique. Celle-ci finit par être insuffisante quand le ventricule devient trop sphérique, ce qui entraîne une dysfonction ventriculaire avec apparition d’une fibrose myocardique et potentiel de récupération réduit ;
• en amont :
– hypertension pulmonaire (HTP) post-capillaire par élévation de la pression de l’atrium gauche (pression artérielle pulmonaire d’occlusion (PAPO) > 15 mmHg et présence d’une onde V de reflux de la fuite dans les veines pulmonaires),
– élévation de la PAP fonction du volume régurgité (ne doit pas dépasser 50 mmHg de PA systolique au repos), de la compliance de l’atrium gauche (le volume de l’atrium gauche en rythme sinusal ne doit pas dépasser 60 mL/m2 et il faut rechercher à fibrillation atriale paroxystique) et des veines pulmonaires.
En effet, dans l’IM primitive chronique, il existe fréquemment une dilatation de l’AG qui permet de maintenir la pression intra-atriale pratiquement normale malgré un volume régurgité parfois important et donc une PAP normale ou peu élevée. Cependant, la dilatation de l’AG peut favoriser la survenue de trouble du rythme atrial.
Chez certains patients, la dilatation atriale peut être isolée, sans dilatation significative du ventricule gauche (il se discute parfois une indication chirurgicale en cas de dilatation importante > 60 mL/m2). Lorsque le volume régurgité devient trop important et que la compliance de l’AG ne peut plus augmenter, la pression dans l’AG et les vaisseaux pulmonaires augmente (HTAP),
– en cas d’IM aiguë : la régurgitation aiguë de sang dans un AG qui n’a pas eu le temps de se dilater avec une compliance d’emblée inadaptée a pour conséquence une HTP immédiatement importante.
IV Étiologies
![]() On distingue aujourd’hui les IM primitives dans lesquelles l’anomalie initiale se situe au niveau des feuillets valvulaires ou des cordages, des IM secondaires dans lesquelles l’anomalie se situe au niveau des ventricules ou de l’anneau qui se dilate (que l’on appelait parfois avant IM fonctionnelles) (cf. fig. 8.7).
On distingue aujourd’hui les IM primitives dans lesquelles l’anomalie initiale se situe au niveau des feuillets valvulaires ou des cordages, des IM secondaires dans lesquelles l’anomalie se situe au niveau des ventricules ou de l’anneau qui se dilate (que l’on appelait parfois avant IM fonctionnelles) (cf. fig. 8.7).
A Insuffisance mitrale primitive (organique) avec excès de jeu valvulaire (type II de Carpentier)
L’IM dystrophique est l’étiologie la plus fréquente des fuites mitrales sévères. Il s’agit d’une insuffisance mitrale primitive.
L’IM dystrophique correspond au type II de Carpentier, caractérisée par des élongations ou des ruptures de cordages, associées ou non à un excès de tissu valvulaire avec ballonnisation, responsables d’un prolapsus valvulaire mitral.
• Une ballonnisation est définie comme un bombement d’un feuillet valvulaire trop ample en systole dans l’AG alors que son bord libre (extrémité) reste dans le plan de l’anneau.
• Le prolapsus survient quand une partie plus ou moins étendue de l’extrémité du feuillet passe en arrière du plan de l’anneau.
L’anomalie peut prédominer sur la valve postérieure (ou petite valve), sur la valve antérieure (ou grande valve) ou les deux.
On distingue deux groupes de lésions, bien que cette distinction soit parfois artificielle :
• les « dégénérescences myxoïdes » (maladie de Barlow). Il y a un excès de tissu, les valves sont le plus souvent redondantes, épaissies. Ceci conduit à un excès de mobilité avec prolapsus. La traction exercée sur les cordages peut conduire à des ruptures ;
• les dégénérescences fibroélastiques, plus fréquentes. Elles surviennent chez les sujets plus âgés, plus souvent les hommes, et intéressent particulièrement la valve postérieure. À l’inverse du cas précédent, la quantité de tissu valvulaire est adaptée à la taille de l’orifice (pas d’excès notable). Le mécanisme essentiel de la fuite est une rupture de cordages.
![]() Les IM dystrophiques peuvent parfois se rencontrer dans le cadre d’une maladie de Marfan ou d’Ehlers-Danlos.
Les IM dystrophiques peuvent parfois se rencontrer dans le cadre d’une maladie de Marfan ou d’Ehlers-Danlos.
B Insuffisance mitrale secondaire (fonctionnelle) par limitation du jeu valvulaire en systole (type IIIb de Carpentier)
![]() Il s’agit d’un nom générique regroupant deux entités distinctes : le remodelage chronique ventriculaire gauche post-infarctus mais aussi celui survenant lors d’une cardiomyopathie dilatée non ischémique (cf. fig. 8.7).
Il s’agit d’un nom générique regroupant deux entités distinctes : le remodelage chronique ventriculaire gauche post-infarctus mais aussi celui survenant lors d’une cardiomyopathie dilatée non ischémique (cf. fig. 8.7).
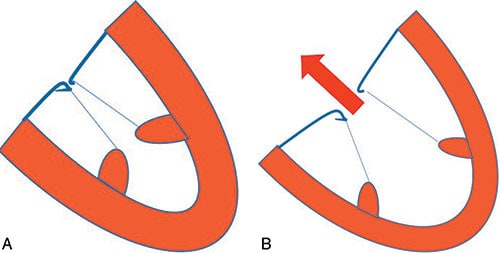
A. Ventricule normal. B. Ventricule dilaté. Le ventricule, en se dilatant, déplace les piliers et empêche la fermeture de la valve mitrale : IM secondaire. La valve n’est pas malade, le ventricule l’est, en opposition avec l’IM primitive où la valve est pathologique et la présence d’une régurgitation mitrale entraîne l’altération de la fonction ventriculaire.
C Insuffisance mitrale primaire rhumatismale et apparentées (restriction systolodiastolique, type IIIa de Carpentier)
Elle est devenue rare depuis la prévention du rhumatisme articulaire aigu.
Elle est le plus souvent associée à un rétrécissement mitral et à une atteinte de la valve aortique.
Les valves sont épaissies, rétractées. L’appareil sous-valvulaire est remanié, les cordages raccourcis. Des ruptures de cordages sont possibles.
Il s’agit d’IM « restrictive », de type III de Carpentier.
L’association d’une sténose et d’une insuffisance mitrale est désignée sous le terme de « maladie mitrale ».
Pour les IM apparentées, il peut s’agir :
• de lésions très proches du rhumatisme articulaire aigu dans le cas des IM médicamenteuses : dérivés ergots de seigle, anorexigènes (fenfluramine, benfluorex, retirés du marché) ;
• d’IM secondaires aux lésions induites par la radiothérapie (lésions chroniques).
D Insuffisance mitrale atriale, par dilatation de l’anneau (type I de Carpentier)
Elle est plus rare, liée à une dilatation de l’anneau sur des atriums très dilatés. La dilatation annulaire peut aussi participer aux IM secondaires.
E Insuffisance mitrale sur endocardite
Elle survient dans plus de la moitié des cas sur une lésion préexistante, prolapsus valvulaire mitral ou IM d’une autre étiologie.
Les lésions sont végétantes (présence de végétations) et mutilantes (destruction du feuillet).
L’insuffisance mitrale est le plus souvent en rapport avec des ruptures de cordages (type II de Carpentier) ou des perforations ou déchirures valvulaires (type I de Carpentier), surtout de la valve antérieure.
F Causes rares
Il peut s’agir :
• d’IM ischémique aiguë par dysfonction ou rupture de pilier (cf. chapitre 5 : Rupture (totale ou partielle) de pilier mitral), entraînant un choc, une régurgitation très sévère et constituant une urgence chirurgicale le plus souvent ;
• de cardiomyopathie hypertrophique (CMH) avec obstruction : le feuillet antérieur est « aspiré » dans la chambre de chasse du ventricule gauche en systole (SAM : mouvement systolique antérieur de la valve mitrale). Il y a de fait un défaut de coaptation de la valve mitrale et une fuite qui peut être sévère ;
• d’une origine congénitale par « fente » de la valve antérieure mitrale ou dans le cadre d’un canal atrioventriculaire ;
• d’une origine traumatique, consécutive à un traumatisme fermé du thorax (très rare) ;
• de dystrophies conjonctivoélastiques (syndrome de Marfan, syndrome d’Ehlers-Danlos, pseudo-xanthome élastique, etc.) : donnant des fuites dystrophiques avec prolapsus ;
• de fibrose endomyocardique des syndromes hyperéosinophiliques ;
• de la survenue au cours d’un lupus ;
• de calcifications de l’anneau mitral, d’origine dégénérative.
V Causes des insuffisances mitrales aiguës
Les insuffisances mitrales aiguës peuvent survenir par :
• rupture de cordages en cas :
– de dégénérescence myxoïde ou fibroélastique,
– d’endocardite,
– de traumatisme thoracique ;
• rupture de pilier :
– infarctus du myocarde,
On peut rencontrer là un œdème pulmonaire unilatéral avec une régurgitation sévère « directionnelle » n’allant que dans les veines pulmonaires d’un seul poumon
– traumatisme ;
• dysfonction de pilier ischémique :
– pilier postérieur par défaut de perfusion de l’artère interventriculaire postérieure,
– pilier antérieur par défaut de perfusion de l’artère interventriculaire antérieure ou de l’artère circonflexe ;
• perforation par endocardite.
| La régurgitation mitrale aiguë est le plus souvent responsable d’un tableau hémodynamique grave justifiant une prise en charge en urgence (urgence vitale). |
VI Clinique
A Circonstances de découverte
Ce sont :
• la découverte d’un souffle à l’occasion d’une visite systématique ;
• des signes fonctionnels : palpitations, dyspnée d’effort ou asthénie d’effort ;
• une complication, par exemple : œdème aigu du poumon ou fibrillation atriale ;
• une fièvre prolongée (forme endocarditique).
B Signes fonctionnels
• Ils sont absents en cas d’IM modérée, mais un patient avec IM sévère peut parfois être asymptomatique.
• Une dyspnée d’effort s’installe souvent lentement et progressivement dans l’IM chronique. Il faut savoir rechercher cette dyspnée et cette altération des performances physiques au fil du temps, parfois associée à une asthénie d’effort.
• Puis tardivement, on observe dyspnée de repos, palpitations, orthopnée, dyspnée paroxystique nocturne.
• L’OAP fait partie des signes fonctionnels de l’IM. Mais c’est un signe tardif et de gravité.
C Examen clinique
1 Palpation
Elle retrouve :
• un frémissement systolique à l’apex ;
• une déviation et un abaissement du choc de pointe en cas de dilatation du VG.
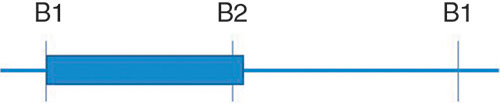
2 Auscultation
Elle met en évidence un souffle holosystolique de régurgitation, débutant dès B1 et se poursuivant jusqu’à B2 qu’il peut dépasser (cf. fig. 8.8) :
• maximum à la pointe ou de siège apexoaxillaire (foyer mitral) ;
• de timbre en « jet de vapeur », doux, parfois rude ;
• d’intensité variable ;
• avec irradiation, le plus souvent vers l’aisselle sauf dans le prolapsus du feuillet postérieur où elle peut se faire vers la base du cœur (foyer aortique) ;
• ne se renforçant pas après une diastole longue.
| Attention Dans le prolapsus, ce souffle débute parfois après B1 par un clic mésosystolique (mise en tension des cordages), et il est donc mésotélésystolique ou télésystolique. |
Les autres signes suivants peuvent être présents si l’IM est importante :
• galop protodiastolique (B3) ;
• roulement mésodiastolique ;
• éclat de B2 en cas d’HTP ;
• souffle d’insuffisance tricuspidienne fonctionnelle en cas d’IM évoluée avec HTAP et retentissement important sur les cavités droites.
L’auscultation pulmonaire peut retrouver des râles crépitants d’insuffisance cardiaque gauche.
| Attention Le souffle des IM secondaires est souvent très discret et même quelquefois inaudible. |
VII Examens complémentaires
A ECG
![]() Il reste longtemps normal dans les IM mais peut objectiver :
Il reste longtemps normal dans les IM mais peut objectiver :
• une hypertrophie atriale gauche ;
• une hypertrophie ventriculaire gauche ;
• une fibrillation atriale ;
• une hypertrophie ventriculaire droite des IM évoluées avec HTAP sévère.
B Radiographie thoracique
Normale dans les IM minimes ou modérées, elle permet d’observer :
• une cardiomégalie par dilatation du VG dans les IM plus importantes ;
• une dilatation de l’atrium gauche (arc moyen gauche convexe, débord arc inférieur droit) ;
• des signes d’HTAP et d’insuffisance cardiaque en cas d’IM chronique évoluée ou aiguë :
– dilatation des artères pulmonaires,
– redistribution vasculaire vers les sommets,
– lignes de Kerley,
– aux bases,
– œdème alvéolaire.
C Échocardiographie doppler
• ![]() L’échocardiographie doppler transthoracique (ETT) est l’examen clé pour :
L’échocardiographie doppler transthoracique (ETT) est l’examen clé pour :
– le diagnostic positif ;
– le diagnostic étiologique ;
– le diagnostic de sévérité : quantification de la fuite et appréciation de son retentissement d’amont et d’aval.
• L’échocardiographie transœsophagienne complète l’étude des causes et aide à planifier le geste de réparation valvulaire.
1 Diagnostic positif
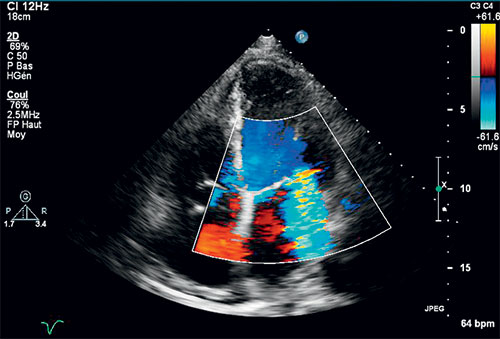
La fuite est confirmée par un signal doppler holosystolique en arrière du plancher mitral enregistré en doppler pulsé, continu et couleur (cf. fig. 8.9).
Fig. 8.9 ![]() Échocardiographie couplée au doppler couleur : présence d’un jet dans l’atrium gauche en systole traduisant la régurgitation mitrale en incidence apicale 4 cavités.
Échocardiographie couplée au doppler couleur : présence d’un jet dans l’atrium gauche en systole traduisant la régurgitation mitrale en incidence apicale 4 cavités.
2 Diagnostic étiologique
L’échocardiographie doppler permet de préciser le mécanisme (selon la classification de Carpentier) (cf. fig. 8.10 et fig. 8.11).
L’ETO est importante pour préciser les mécanismes et la faisabilité d’un geste chirurgical réparateur. Elle est pratiquée une fois lors du bilan préopératoire. L’indication opératoire est portée en amont. L’ETO est un examen fondamental pour le diagnostic des IM sur endocardite en mettant en évidence les végétations parfois très fines et impossibles à voir en ETT (cf. fig. 8.12). De même, l’ETO permet le diagnostic de ruptures partielles de cordages difficiles à documenter en ETT et précise les segments des feuillets mitraux atteints en cas de prolapsus guidant le chirurgien dans sa technique opératoire.
Fig. 8.10 ![]() Échocardiographie bidimensionnelle d’un prolapsus du feuillet postérieur avec probable rupture de cordage en incidence parasternale grand axe.
Échocardiographie bidimensionnelle d’un prolapsus du feuillet postérieur avec probable rupture de cordage en incidence parasternale grand axe.
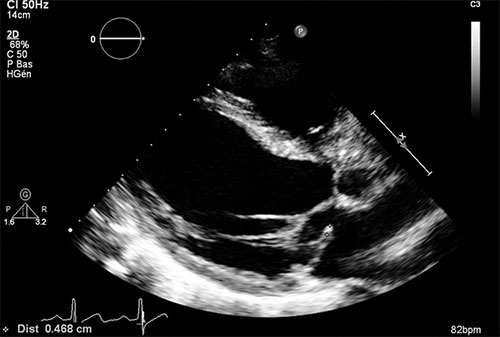
Fig. 8.11 ![]() Échocardiographie couplée au doppler couleur mettant en évidence le jet d’insuffisance mitrale excentré vers la partie postérieure de l’aorte en rapport avec le prolapsus du feuillet postérieur en incidence parasternale grand axe.
Échocardiographie couplée au doppler couleur mettant en évidence le jet d’insuffisance mitrale excentré vers la partie postérieure de l’aorte en rapport avec le prolapsus du feuillet postérieur en incidence parasternale grand axe.
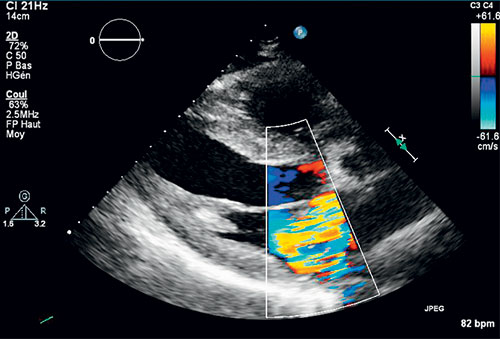
Fig. 8.12 ![]() Exemple d’endocardite avec une végétation.
Exemple d’endocardite avec une végétation.
3 Diagnostic de sévérité
![]() La quantification de la régurgitation repose sur l’utilisation de plusieurs approches dont les propriétés de l’effet doppler. La technique de la PISA (Proximal Isovelocity Surface Area) permet le calcul de la surface de l’orifice régurgitant (SOR).
La quantification de la régurgitation repose sur l’utilisation de plusieurs approches dont les propriétés de l’effet doppler. La technique de la PISA (Proximal Isovelocity Surface Area) permet le calcul de la surface de l’orifice régurgitant (SOR).
On distingue 4 grades de sévérité croissante (cf. tableau 8.1).
On définit une IM significative par un VR supérieur à 45 mL et une fraction de régurgitation supérieure à 50 %.
Le retentissement est apprécié par :
• le degré de dilatation du VG (diamètre télésystolique ≥ 40 mm) ;
• la fonction VG (fraction d’éjection ≤ 60 %) ; cette étude de la FEVG peut être faussement rassurante, il est proposé de compléter par l’étude des déformations longitudinales (strain) ou de l’IRM à la recherche de fibrose (en cas de doute sur l’indication opératoire) ;
• la taille de l’atrium gauche ≥ 60 mL/m2 ;
• le niveau des pressions droites (PAP systolique ≥ 50 mmHg en échocardiographie et possiblement à confirmer en cathétérisme droit).
Dans le cadre des IM secondaire, le seuil de sévérité est à 30 mm2 pour la SOR. La fuite mitrale secondaire doit être évaluée plusieurs fois et doit l’être uniquement après optimisation du traitement médical de l’insuffisance cardiaque. En effet, la fuite mitrale secondaire est dépendante de la volémie et réputée comme « accordéon » selon les conditions de charge.
Tableau 8.1 ![]() Grades de l’insuffisance mitrale (IM) primitive.
Grades de l’insuffisance mitrale (IM) primitive.
| Grade | Surface d’orifice régurgitant (SOR) (mm2) | Volume de régurgitation par battement (mL) |
|---|---|---|
| Grade I : IM minime | < 20 | < 30 |
| Grade II : IM modérée | 20–29 | 30–44 |
| Grade III : IM importante | 30–39 | 45–59 |
| Grade IV : IM massive | ≥ 40 | ≥ 60 |
4 Vérification des autres valves
![]() Il s’agit en particulier de la valve tricuspide qui peut être le siège d’un prolapsus, d’une dilatation de l’anneau et donc d’une fuite qu’il faudra peut-être aussi corriger lors de l’intervention sur la valve mitrale.
Il s’agit en particulier de la valve tricuspide qui peut être le siège d’un prolapsus, d’une dilatation de l’anneau et donc d’une fuite qu’il faudra peut-être aussi corriger lors de l’intervention sur la valve mitrale.
![]() Soulignons qu’une fuite même non sévère avec un anneau de plus de 40 mm en coupe apicale 4 cavités (ETT) justifie de planifier, en plus du geste sur la valve mitrale, une annuloplastie tricuspide.
Soulignons qu’une fuite même non sévère avec un anneau de plus de 40 mm en coupe apicale 4 cavités (ETT) justifie de planifier, en plus du geste sur la valve mitrale, une annuloplastie tricuspide.
D Coroscanner
![]() En cas de faible probabilité prétest de coronaropathie (faible niveau de risque), le coroscanner peut être proposé pour exclure l’existence d’une coronaropathie en préopératoire.
En cas de faible probabilité prétest de coronaropathie (faible niveau de risque), le coroscanner peut être proposé pour exclure l’existence d’une coronaropathie en préopératoire.
E Coronarographie et cathétérisme
L’évaluation du réseau coronarien dans le cadre du bilan préopératoire est fondamentale (si le coroscanner n’a pas été choisi) pour envisager éventuellement un geste de revascularisation coronarienne associé. Elle est en général indiquée dans les cas suivants :
• suspicion d’ischémie myocardique ;
• altération de la fonction systolique (baisse de la FEVG) ;
• homme de plus de 40 ans ou femme ménopausée ;
• présence de facteurs de risque cardiovasculaire.
La coronarographie peut être remplacée par un coroscanner.
![]() La ventriculographie (opacification du ventricule par un bolus de produit de contraste) pour quantifier la fuite n’est plus utilisée.
La ventriculographie (opacification du ventricule par un bolus de produit de contraste) pour quantifier la fuite n’est plus utilisée.
Le cathétérisme droit, en revanche, peut être parfois nécessaire. Il permet la mesure du débit cardiaque par thermodilution et également, et cela est fondamental, de mesurer précisément les pressions droites (capillaire et pulmonaire). En effet, la fuite mitrale sévère peut être responsable d’une augmentation de la pression capillaire (PAPO) avec un reflux lié à la fuite donnant une onde V. L’augmentation de la pression artérielle pulmonaire peut être importante mais reste normalement post-capillaire, c’est-à-dire que la PAP diastolique est au niveau de la PAPO.
F Épreuve d’effort classique ou avec mesure de la consommation d’oxygène (épreuve d’effort cardiorespiratoire) et échocardiographie d’effort
Les indications de ces deux examens dynamiques ne sont pas encore bien précisées dans l’évaluation de l’IM. Leur principal intérêt est de démasquer des symptômes et de les comprendre chez des patients qui se disent asymptomatiques.
La VO2 permet de mieux apprécier la capacité à l’effort du patient.
L’échocardiographie d’effort permet d’apprécier la fuite à l’effort, son éventuelle augmentation, son retentissement.
VIII Évolution naturelle et complications
A Évolution naturelle
![]() Elle est fonction :
Elle est fonction :
• de la sévérité de la fuite ;
• de l’étiologie ;
• de la rapidité de la constitution de l’IM ;
• de la fonction ventriculaire ;
• des lésions associées, en particulier de l’existence d’une coronaropathie.
D’une manière générale, les IM constituées progressivement sont bien tolérées pendant longtemps et les signes d’insuffisance cardiaque apparaissent tardivement.
Il faut donc souligner l’importance d’un suivi régulier d’un patient porteur d’une IM même asymptomatique avec la réalisation d’une ETT annuelle.
Au contraire, les IM d’installation brutale (rupture de cordages, endocardite, IM sur infarctus) sont en général mal tolérées et peuvent se compliquer rapidement d’un œdème du poumon.
B Complications
Il peut s’agir :
• de rupture de cordage en cas d’IM dystrophique par prolapsus, parfois dans d’autres étiologies (RAA, CMH) ;
• d’endocardite infectieuse, entraînant souvent une aggravation de la fuite ;
• de troubles du rythme :
– fibrillation atriale ou flutter atrial : leur apparition peut entraîner une décompensation cardiaque. Ils sont favorisés par la dilatation de l’atrium gauche : ceci justifie de discuter la correction de la fuite mitrale,
– troubles du rythme ventriculaire plus rares, traduisant en général une détérioration de la fonction ventriculaire.
![]() Il peut aussi y avoir des troubles du rythme ventriculaire associés aux prolapsus mitraux même en l’absence de fuite sévère lorsqu’il y a une anomalie anatomique marquée avec ce qu’on appelle une disjonction annulaire qui est classiquement retrouvée chez la femme jeune ayant des extrasystoles et des ondes T négatives dans le précordium à l’ECG. Exceptionnellement, ce type de prolapsus mitral peut être une cause de mort subite ;
Il peut aussi y avoir des troubles du rythme ventriculaire associés aux prolapsus mitraux même en l’absence de fuite sévère lorsqu’il y a une anomalie anatomique marquée avec ce qu’on appelle une disjonction annulaire qui est classiquement retrouvée chez la femme jeune ayant des extrasystoles et des ondes T négatives dans le précordium à l’ECG. Exceptionnellement, ce type de prolapsus mitral peut être une cause de mort subite ;
• ![]() d’insuffisance cardiaque :
d’insuffisance cardiaque :
– d’apparition généralement tardive dans les IM chroniques,
– pouvant survenir rapidement en cas d’IM aiguë,
– pouvant être favorisée par un trouble du rythme.
IX Traitement
A Surveillance
![]() Elle concerne l’IM minime ou modérée (grade I ou II). Elle consiste en :
Elle concerne l’IM minime ou modérée (grade I ou II). Elle consiste en :
• une réévaluation clinique et échocardiographique régulière ;
• la prévention (oslérienne) de l’endocardite par des soins dentaires réguliers essentiellement.
B Traitement médical
• Si la fuite mitrale est importante et responsable d’une symptomatologie fonctionnelle, c’est qu’il est urgent de penser à la chirurgie.
• Il n’existe pas de traitement médical de la régurgitation mitrale, cependant :
– en cas de poussée d’insuffisance cardiaque, on traite classiquement (diurétique-vasodilatateur) ;
– en cas d’IM aiguë, on traite l’OAP ou le choc et on discute de la chirurgie en urgence ;
– une anticoagulation orale est prescrite en cas de fibrillation atriale ;
– des bêtabloquants sont prescrits en cas de maladie de Marfan (pour réduire le risque de dissection aortique).
C Chirurgie et traitement percutané
1 Plastie reconstructrice = traitement chirurgical « idéal »
• Elle respecte l’appareil sous-valvulaire et entraîne moins de dysfonctions VG postopératoires qu’un remplacement valvulaire.
• Elle est associée à une moindre morbimortalité à long terme que le remplacement prothétique.
• Elle expose à un moindre risque d’endocardite infectieuse.
• Indiquée dans les prolapsus avec ou sans rupture de cordages, son résultat à long terme est bon.
• Elle est possible mais difficile dans certains cas d’IM post-rhumatismale si la valve n’est pas trop remaniée et dans certains cas d’IM ischémique, mais il existe un risque de récidive de l’IM à moyen et long terme.
• Ce geste nécessite une expérience importante du chirurgien.
• La plastie reconstructrice n’est pas possible dans tous les cas d’IM.
2 Remplacement valvulaire
En l’absence de possibilité de plastie reconstructrice, c’est-à-dire en cas de valve et appareil sous-valvulaire trop remaniés, il se fait par :
• prothèse mécanique :
– imposant un traitement anticoagulant,
– sa durée de vie est longue,
– souvent préférée en cas de nécessité par ailleurs d’un traitement anticoagulant, par exemple si une fibrillation atriale est associée ;
• prothèse biologique (bioprothèse) :
– ne nécessitant pas un traitement anticoagulant au long cours,
– associée à des risques de dégénérescence à terme,
– indiquée en cas de contre-indication aux anticoagulants.
Le choix entre prothèses mécanique et biologique dépend essentiellement de l’âge du patient, du rythme (sinusal, FA, etc.), de la préférence du patient et du risque du traitement anticoagulant. Après 70 ans, on s’oriente le plus souvent vers une bioprothèse, et avant 65 ans vers une prothèse mécanique.
3 Traitement percutané
![]() Des techniques de cardiologie interventionnelle permettent de réaliser une correction de la fuite mitrale par voie percutanée, en rapprochant grâce à un clip les feuillets mitraux antérieur et postérieur (recommandations ESC 2021). Des registres et deux études randomisées récentes ont permis de déterminer les bénéfices et limites de tels systèmes en cas d’IM primaires et secondaires.
Des techniques de cardiologie interventionnelle permettent de réaliser une correction de la fuite mitrale par voie percutanée, en rapprochant grâce à un clip les feuillets mitraux antérieur et postérieur (recommandations ESC 2021). Des registres et deux études randomisées récentes ont permis de déterminer les bénéfices et limites de tels systèmes en cas d’IM primaires et secondaires.
4 Bilan préopératoire
• ![]() Il doit permettre d’évaluer le risque opératoire.
Il doit permettre d’évaluer le risque opératoire.
• Il comporte en général :
– imagerie des coronaires (coronarographie ou coroscanner) ;
– échodoppler des troncs supra-aortiques ;
– recherche de foyers infectieux de la sphère ORL ou stomatologique avec radiographie des sinus et panoramique dentaire ;
– recherche de comorbidités (fonction rénale, pathologie pulmonaire, etc.) ;
– avis gériatrique chez le sujet très âgé pour bien peser le rapport risque/bénéfice de la procédure.
D « Cliniques des valves » et Heart Team
![]() Pour les IM primitives, comme les IM secondaires, il existe des systèmes de réparation bord à bord percutanée ainsi que de nouvelles prothèses implantables par voie percutanée en cours de validation.
Pour les IM primitives, comme les IM secondaires, il existe des systèmes de réparation bord à bord percutanée ainsi que de nouvelles prothèses implantables par voie percutanée en cours de validation.
Ces différentes options thérapeutiques pour un même patient justifient le concept de :
• clinique des valves regroupant les expertises, cliniques, d’imagerie, de chirurgie, d’anesthésie, de cathétérisme interventionnel ;
• la discussion collégiale pour proposer à chaque patient, le choix de la meilleure stratégie selon l’expertise de chaque centre. Les recommandations actuelles insistent sur la nécessité d’adresser les patients à une équipe pluridisciplinaire avec des compétences propres pour prendre les meilleures décisions (niveau 1 des recommandations ESC 2021).
E Indications thérapeutiques
• Une IM aiguë mal tolérée requiert une chirurgie urgente.
• Le traitement d’une IM chronique importante (grade III ou IV) chez un patient symptomatique repose sur la chirurgie en privilégiant si possible la plastie reconstructrice. Une plastie reconstructrice peut toujours être envisagée même en cas de dysfonction VG. Si la plastie n’est pas réalisable :
– on effectue un remplacement valvulaire en cas de FE > 30 % ;en cas de FE < 30 %, le remplacement valvulaire devient contre-indiqué, il faut alors en rester au traitement médical ou, si le patient est encore relativement jeune, discuter une transplantation cardiaque ;
– ![]() le traitement percutané par réparation bord à bord peut être envisagé en cas d’insuffisance mitrale dystrophique chez les patients symptomatiques qui remplissent les critères précis échocardiographiques d’éligibilité et jugés inopérables ou à haut risque chirurgical par l’équipe multidisciplinaire et pour lesquels la procédure n’est pas considérée comme futile ;
le traitement percutané par réparation bord à bord peut être envisagé en cas d’insuffisance mitrale dystrophique chez les patients symptomatiques qui remplissent les critères précis échocardiographiques d’éligibilité et jugés inopérables ou à haut risque chirurgical par l’équipe multidisciplinaire et pour lesquels la procédure n’est pas considérée comme futile ;
– la persistance d’une IM importante secondaire à l’insuffisance cardiaque malgré un traitement optimal est associée à une surmortalité, des hospitalisations plus fréquentes et des symptômes plus marqués. Sur la base de critères échocardiographiques précis et d’une discussion multidisciplinaire, il est possible de proposer un traitement percutané de l’IM par clip si l’insuffisance cardiaque n’est pas trop avancée.
• ![]() Le traitement d’une IM chronique importante (grade III ou IV) chez un patient asymptomatique repose sur :
Le traitement d’une IM chronique importante (grade III ou IV) chez un patient asymptomatique repose sur :
– la chirurgie en privilégiant si possible la plastie reconstructrice si l’IM retentit sur le VG avec au moins un des signes suivants :
- diamètre télésystolique (DTS) du VG > 40 mm et rupture de cordage,
- FEVG ≤ 60 %,
- élévation des pressions droites au repos (PAP systolique ≥ 50 mmHg),
- fibrillation atriale associée ou dilatation importante de l’AG (> 60 mL/m2) ;
– le plus souvent, une surveillance avec échographie doppler tous les 6 mois dans les autres cas et la chirurgie en cas d’apparition :
- d’un retentissement de l’IM (FE, DTS) d’un examen échocardiographique à l’autre,
- de symptômes (dyspnée d’effort),
- de trouble du rythme supraventriculaire (FA).
Points-clés
| • L’IM est caractérisée à l’auscultation par un souffle apexoaxillaire, holosystolique de régurgitation débutant dès B1, ou par un souffle mésosystolique ou télésystolique précédé par un clic en cas de prolapsus. • • L’examen clé est l’échocardiographie doppler par voie transthoracique complétée si besoin par une échocardiographie par voie transœsophagienne qui : confirme le diagnostic d’IM et en précise le mécanisme ; quantifie son degré de sévérité (mesures précises du volume régurgité, et de la surface de l’orifice régurgité) ; évalue la fonction VG et les autres valves. • L’ETO est importante dans l’évaluation de l’IM (mécanisme de l’IM, végétations, ruptures de cordages, quantification) et l’appréciation de la faisabilité d’une plastie chirurgicale quand la voie transthoracique ne répond pas à toutes les questions. • Autrefois examen de référence, le cathétérisme présente un intérêt limité dont les mesures peuvent être obtenues par l’échocardiographie doppler. Son seul intérêt repose sur la coronarographie avant l’intervention chirurgicale chez les patients ayant un angor d’effort ou des facteurs de risque de la maladie coronarienne, ou systématiquement chez les patients âgés. • – pas d’intervention en cas d’IM isolée de grade I-II ; – surveillance clinique et échocardiographique tous les 6 mois dans les autres cas ; – indication chirurgicale en cas d’IM importante de grade III ou IV symptomatique en privilégiant la plastie reconstructrice si possible. Le remplacement valvulaire (prothèse mécanique ou biologique) n’est pas envisageable si la FE est < 30 %, contrairement à la plastie reconstructrice ; – chez un patient asymptomatique, intervention chirurgicale en cas de dilatation du VG (DTS ventriculaire > 40 mm) et/ou fraction d’éjection < 60 % et/ou élévation de la PAP et/ou fibrillation atriale associée. On a de nos jours tendance à opérer plus tôt si l’on a la quasi-certitude que le chirurgien peut faire une plastie reconstructrice plutôt qu’un remplacement valvulaire. |
Notions indispensables et inacceptables
Notions indispensables
• Classification de Carpentier des mécanismes de l’IM.
• On opère les patients symptomatiques ayant une IM importante (grade III ou IV).
• On peut opérer les patients asymptomatiques ayant une IM importante quand il existe des signes échocardiographiques de mauvaise tolérance ou une fibrillation atriale.
• La chirurgie de réparation valvulaire doit être privilégiée dans les prolapsus.
• Ne pas oublier la coronarographie dans le bilan préopératoire.
Notions inacceptables
• Oublier l’éducation thérapeutique du patient connu pour une IM concernant la prévention de l’endocardite infectieuse et, le cas échéant, une consultation urgente si apparaissent des symptômes à l’effort.
• Ne pas penser à une endocardite infectieuse en cas de fièvre.
• Ne pas référer à un spécialiste un patient porteur d’une IM symptomatique.
• Ne pas référer à un spécialiste un patient d’une IM avec un souffle modifié, ou des symptômes nouveaux.
• Ne pas référer à un spécialiste un patient porteur d’une IM pour son suivi annuel.
Réflexes transversalité
• Item 152 – Endocardite infectieuse
• Item 153 – Surveillance des porteurs de valves et prothèses vasculaires
Insuffisance aortique
I. Définition
II. Rappel anatomique
III. Physiopathologie
IV. Étiologies
V. Clinique
VI. Examens complémentaires
VII. Diagnostic différentiel
VIII. Évolution et complications
IX. Surveillance
X. Traitement
I Définition
• ![]() La régurgitation valvulaire aortique, ou fuite aortique, ou « insuffisance » aortique (IA) est un reflux (régurgitation, retour) de sang de l’aorte vers le ventricule gauche en diastole.
La régurgitation valvulaire aortique, ou fuite aortique, ou « insuffisance » aortique (IA) est un reflux (régurgitation, retour) de sang de l’aorte vers le ventricule gauche en diastole.
• L’IA est une valvulopathie peu fréquente, dont la prévalence augmente avec l’âge.
II Rappel anatomique
• La racine aortique et la valve aortique peuvent être impliquées dans la genèse d’une IA.
• La racine aortique (cf. fig. 8.13) comporte plusieurs éléments :
– l’anneau aortique sur lequel s’insèrent les feuillets valvulaires ou cusps ;
– les sinus aortiques (ou sinus de Valsalva) ;
– la jonction sinotubulaire ;
– l’aorte initiale.
• La valve aortique (cf. fig. 8.14) est normalement constituée de 3 feuillets valvulaires (elle est dite tricuspide) également appelés cusps ou sigmoïdes : 1 cusp antéro-droite en regard du sinus aortique antéro-droit, 1 cusp antéro-gauche en regard du sinus antéro-gauche, et 1 cusp non coronaire (sinus postérieur ou non coronaire).
• Chez 1–2 % de la population générale, la valve aortique est constituée de seulement 2 cusps, par fusion ou défaut de séparation embryologique de 2 cusps. Il s’agit d’une anomalie congénitale, qui apparaît lors du développement fœtal. On parle de bicuspidie aortique (cf. fig. 8.15).
Fig. 8.13 ![]() Racine de l’aorte vue « de profil » en échocardiographie, avec ses différents composants, l’anneau aortique, les sinus aortiques (ou de Valsalva), la jonction sinotubulaire, et l’aorte ascendante dans sa portion initiale.
Racine de l’aorte vue « de profil » en échocardiographie, avec ses différents composants, l’anneau aortique, les sinus aortiques (ou de Valsalva), la jonction sinotubulaire, et l’aorte ascendante dans sa portion initiale.
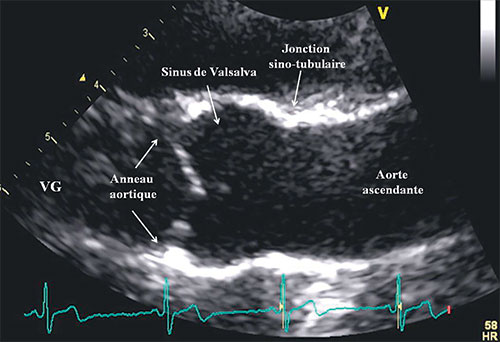
Fig. 8.14 ![]() Anatomie normale de la valve aortique
Anatomie normale de la valve aortique
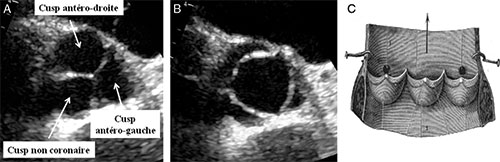
A. Valve aortique de face avec les 3 cusps fermées en échocardiographie. B. Valve aortique avec les 3 cusps ouvertes. C. Schéma anatomique « déroulé » de la valve aortique d’après Léonard de Vinci (XVe siècle) montrant la forme en « nid d’hirondelle » ou en « balconnet » des cusps aortiques.
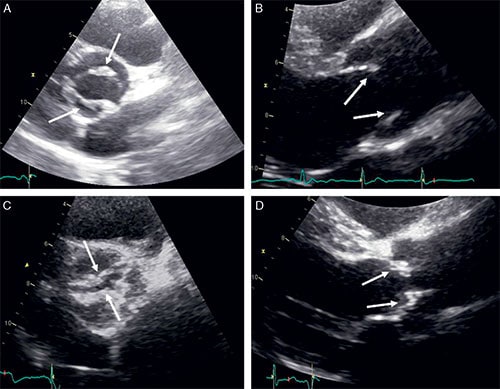
A, C. Aspect de bicuspidie aortique (flèches montrant les 2 cusps). B, D. Limitation d’ouverture des cusps aortiques (flèches), souvent épaissies et rigides dans la bicuspidie.
III Physiopathologie
• ![]() Les trois paramètres impliqués dans la physiopathologie de l’IA sont le ventricule gauche, la valve aortique et la circulation artérielle systémique (en particulier l’aorte).
Les trois paramètres impliqués dans la physiopathologie de l’IA sont le ventricule gauche, la valve aortique et la circulation artérielle systémique (en particulier l’aorte).
• L’IA chronique est une valvulopathie qui est longtemps bien tolérée.
A Insuffisance aortique chronique
• Le volume de la fuite est lié à la taille de l’orifice régurgitant, à la durée de la diastole et au gradient de pression de part et d’autre de l’orifice aortique en diastole.
• L’IA constitue une surcharge mécanique mixte du VG :
– surcharge volumétrique : liée au volume sanguin régurgité en diastole dans le VG (augmentation du volume télédiastolique et donc de la précharge) ;
– surcharge barométrique : l’augmentation du volume d’éjection systolique dans l’aorte (volume d’éjection normal + volume régurgité) induit une élévation de pression systolique aortique (augmentation de la postcharge).
• L’augmentation de la précharge et de la postcharge conditionne le retentissement sur le VG :
– la surcharge volumétrique et barométrique du VG entraîne un remodelage du VG qui vise à normaliser la contrainte pariétale excessive diastolique et systolique ;
– la contrainte ou tension pariétale peut être approchée par la loi ou équation de Laplace (tension pariétale T = P × r/2e où P est la pression intracavitaire, r le rayon de la cavité et e l’épaisseur pariétale). r augmente du fait de la régurgitation aortique, P augmente du fait de l’élévation de la postcharge, e augmente progressivement pour normaliser la contrainte pariétale ;
– le remodelage VG à type d’hypertrophie excentrique est plus marqué en termes de dilatation cavitaire et d’hypertrophie pariétale que pour l’IM ;
– ce remodelage VG est par nature pathologique, mal adaptatif, médié par de nombreux processus biologiques qui induisent à terme une destruction cardiomyocytaire et une fibrose interstitielle ;
– au début de l’évolution, l’hypertrophie myocardique compensatrice permet de maintenir une fonction systolique VG normale ;
– la compliance du VG est grande, si bien que le VG peut fonctionner avec des pressions de remplissage normales pendant de nombreuses années malgré une dilatation importante ;
– progressivement apparaissent une altération de la contractilité et de la compliance ventriculaire (baisse de la fraction d’éjection et élévation des pressions de remplissage VG), et une insuffisance cardiaque d’effort puis de repos ;
– lorsque le VG est très dilaté ou que la fraction d’éjection (FE) est abaissée, le remodelage VG peut être irréversible et ne pas récupérer après traitement chirurgical.
• Au niveau aortique, on observe deux phénomènes :
– une augmentation de la pression artérielle systolique, qui dépend du volume d’éjection systolique et de la compliance aortique ;
– une baisse de la pression artérielle diastolique du fait de la régurgitation lorsque le volume de l’IA est important.
• Ceci explique les signes cliniques d’hyperpulsatilité artérielle, par augmentation de la pression artérielle différentielle ou pression pulsée (différence entre la pression systolique et diastolique).
• La baisse de la pression diastolique dans l’aorte peut affecter la circulation coronarienne :
on observe une baisse de la perfusion coronarienne qui se fait normalement surtout en diastole ;
lorsque l’IA est sévère, elle peut même entraîner un « vol » coronarien (aspiration par la fuite du sang artériel coronarien en diastole) ;
l’hypoperfusion coronarienne peut se traduire par un angor de repos ou d’effort, et entraîner une ischémie myocardique participant à la genèse de la fibrose myocardique.
B Insuffisance aortique aiguë
• Il s’agit surtout d’une endocardite infectieuse (EI) responsable de la survenue brutale d’une IA volumineuse, donc d’une surcharge volumétrique très importante, sur une cavité VG de taille normale ou peu dilatée à compliance normale. Il en résulte une élévation brutale des pressions de remplissage (en diastole) du VG, donc une élévation des pressions dans l’atrium gauche et la circulation pulmonaire, conduisant à un œdème pulmonaire.
• L’IA aiguë peut être peu audible à l’auscultation.
• Dans l’IA aiguë, la circulation coronarienne est particulièrement pénalisée du fait de l’augmentation de la contrainte pariétale en diastole et de la diminution de la pression diastolique aortique.
IV Étiologies (cf. tableau 8.2)
![]() Les étiologies de l’IA relèvent de trois mécanismes différents (cf. fig. 8.16), qui peuvent parfois s’associer. Ces trois mécanismes se distinguent par la mobilité des cusps qui peut être normale, augmentée ou restreinte. Lorsqu’une étiologie peut relever de plusieurs mécanismes, le mécanisme principal est cité.
Les étiologies de l’IA relèvent de trois mécanismes différents (cf. fig. 8.16), qui peuvent parfois s’associer. Ces trois mécanismes se distinguent par la mobilité des cusps qui peut être normale, augmentée ou restreinte. Lorsqu’une étiologie peut relever de plusieurs mécanismes, le mécanisme principal est cité.
• On recherche en particulier une lésion organique des cusps (perforation, épaississement, élongation, etc.) et/ou une dilatation de la racine aortique.
Tableau 8.2 ![]() Principales étiologies des insuffisances aortiques.
Principales étiologies des insuffisances aortiques.
| Mouvement valvulaire normal (type 1) | Mouvement valvulaire excessif : prolapsus (type 2) | Mouvement valvulaire restreint (type 3) |
|---|---|---|
| Dilatation de la racine de l’aorte 1) Dilatation idiopathique 2) Maladies syndromiques, génétiques • Maladie de Marfan • Maladie de Loeys-Dietz • Maladie d’Ehlers-Danlos 3) maladies inflammatoires (aortite) • Maladie de Takayasu • Maladie de Horton • Maladie de Behçet • Spondylarthrite ankylosante • Syphilis 4) Bicuspide aortique 5) Dissection aortique Destruction/Perforation valvulaire 1) Endocardite infectieuse 2) Lésion traumatique 3) Fenestration congénitale ou acquise |
Dystrophie ou dysplasie isolée de la valve aortique Bicuspidie aortique Endocardite infectieuse Syndrome de Laubry-Pezzi Déchirure traumatique Dissection aortique |
Rhumatisme articulaire aigu Toxicité médicamenteuse Radiothérapie médiastinale |
Fig. 8.16 ![]() Mécanisme de fuite aortique en fonction de la mobilité des cusps ou sigmoïdes aortiques.
Mécanisme de fuite aortique en fonction de la mobilité des cusps ou sigmoïdes aortiques.
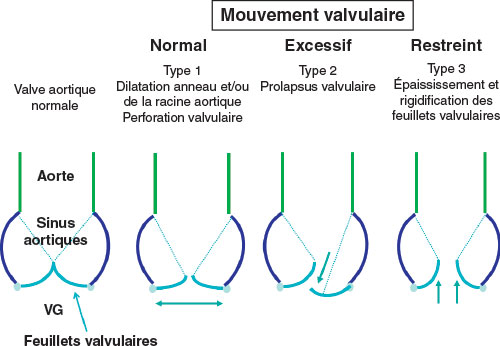
Type 1 : mouvement quasi normal des cusps, type 2 : mouvement excessif en diastole (prolapsus) des cusps (flèche), type 3 : mouvement restreint des cusps (flèches) par atteinte organique.
A Insuffisance aortique avec mouvement normal des cusps
• Lorsque le mouvement des cusps est normal, trois types d’anomalies peuvent expliquer l’IA :
– la dilatation de l’anneau aortique empêchant la coaptation des cusps malgré un mouvement et une structure valvulaire normaux. En pratique, la dilatation de l’anneau aortique est rarement isolée, associée en général à la dilatation de la racine de l’aorte ;
– la dilatation de la racine aortique qui peut prédominer au niveau de l’anneau et des sinus aortiques (cf. fig. 8.17A : maladie annuloectasiante) ou au niveau de l’aorte initiale. Cette situation se rencontre dans certaines maladies génétiques telles que la maladie de Marfan, la maladie de Loeys-Dietz, le syndrome d’Ehlers-Danlos, ou sans cause retrouvée (dilatation dite idiopathique). Elle peut également être la conséquence d’une dilatation de l’aorte initiale sur bicuspidie aortique, ou encore d’une aortite (atteinte inflammatoire de la paroi aortique) telle que la maladie de Takayasu, la maladie de Horton, la maladie de Behçet, la spondylarthrite ankylosante, la syphilis ;
– la perforation ou destruction partielle d’une cusp. L’étiologie est essentiellement l’EI (cf. fig. 8.18) qui peut détruire le bord libre ou perforer le corps d’une cusp, plus rarement des lésions traumatiques (cathétérisme), ou des fenestrations qui sont des petites perforations congénitales ou dégénératives des cusps, siégeant au niveau des zones de coaptation (zones de contact entre 2 cusps).
• La maladie annuloectasiante et la dilatation de l’aorte ascendante exposent au risque de rupture ou de dissection aortique.
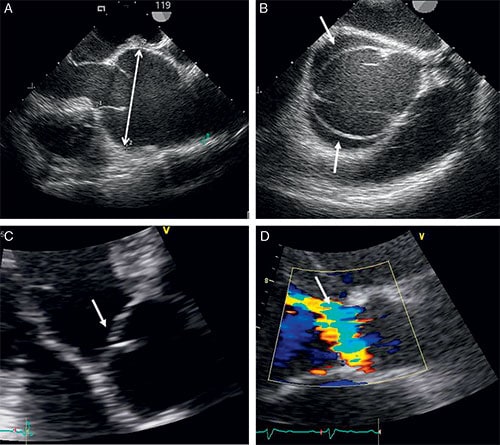
A. Maladie annuloectasiante avec dilatation de l’anneau et des sinus aortiques entraînant un défaut de coaptation des cusps (type 1). B. Aspect de dissection aortique avec désinsertion de la paroi et de la valve (flèche) du culot aortique entraînant une fuite centrale par prolapsus (type 2). C. Prolapsus de cusp (flèche), D. Flux couleur de fuite aortique excentrique sur un prolapsus de cusp.
Fig. 8.18 ![]() Mécanisme de fuite aortique de type 1 : endocardites infectieuses aortiques.
Mécanisme de fuite aortique de type 1 : endocardites infectieuses aortiques.
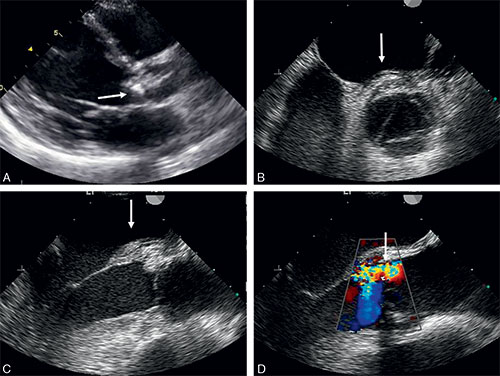
A. Volumineuse végétation (flèche) développée sous la valve aortique dans la chambre de chasse. B, C. Images d’abcès de l’anneau aortique (flèche). D. Insuffisance aortique (flèche indiquant le jet couleur) développée sur l’abcès.
B Insuffisance aortique avec mouvement excessif des cusps
Lorsque le mouvement d’au moins une cusp est excessif, se fermant non pas sur le plan des autres cusps mais sous ce plan dans la chambre de chasse du VG, on parle de prolapsus valvulaire (cf. fig. 8.17C et fig. 8.17D) :
• le prolapsus valvulaire aortique peut être isolé : la valve aortique est tricuspide mais dystrophique (anomalie acquise) voire dysplasique (anomalie de naissance, congénitale). La fuite est excentrée à partir de la cusp qui prolabe ;
• le prolapsus valvulaire aortique peut se rencontrer dans le cadre d’une bicuspidie : la cusp qui prolabe est en général la plus grande, celle qui est constituée par la fusion de 2 cusps ;
• plus rarement, le prolapsus valvulaire peut être la conséquence d’une déchirure traumatique, d’une infection (endocardite infectieuse), ou secondaire à une communication interventriculaire sous-aortique infundibulaire réalisant le syndrome de Laubry-Pezzi.
C Insuffisance aortique avec mouvement restreint des cusps
Lorsque le mouvement d’au moins une cusp est restreint, se fermant non pas sur le plan des autres cusps mais au-dessus de ce plan vers l’aorte, on parle de restriction valvulaire (cf. fig. 8.19) :
• le rhumatisme articulaire aigu (RAA) était la principale cause d’IA restrictive. Il est devenu rare dans les pays occidentaux, on le rencontre néanmoins dans les populations migrantes (Maghreb, Asie, Afrique) ; il peut être associé à une sténose (constituant alors une « maladie aortique »). Les lésions de RAA prédominent en général sur la valve mitrale mais peuvent également atteindre la valve aortique. Le RAA est responsable de lésions progressives des feuillets valvulaires avec épaississement et rétraction des bords libres créant un orifice central (cf. fig. 8.19A et 8.19B) ;
• les lésions médicamenteuses toxiques peuvent être induites par des dérivés de l’ergot de seigle (antimigraineux), des anorexigènes qui ont été retirés du marché tels que la fenfluramine (Ponderal®), la dexfenfluramine (Isomeride®), le benfluorex (Médiator®). Leur toxicité est liée à l’action de dérivés de type sérotonine ;
• d’autres causes sont plus rares : tumeur neuroendocrine (carcinoïde) secrétant de la sérotonine (l’atteinte des valves gauches est rare dans ce cas car la sérotonine sécrétée dans le sang veineux est arrêtée par le filtre pulmonaire), radiothérapie médiastinale (lymphome médiastinal, cancer du sein en particulier gauche).
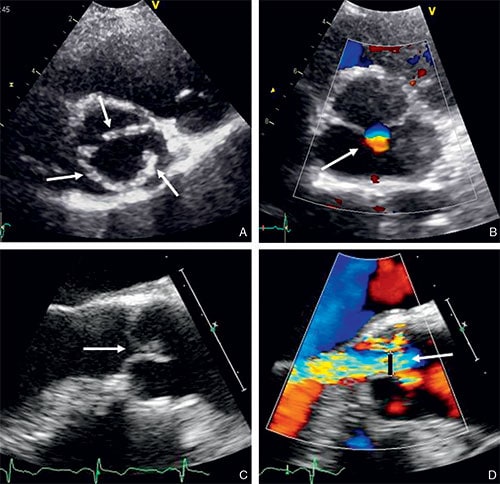
A. Lésions valvulaires rhumatismales (post-rhumatisme articulaire aigu) de la valve aortique avec épaississement et rétraction du bord libre des cusps (flèches montrant le bord libre des cusps en position ouverte). B. Orifice central avec insuffisance aortique (flèche montrant le jet couleur). C. Lésions médicamenteuses (benfluorex) de la valve aortique avec mouvement restreint des cusps (flèche montrant le défaut de fermeture en diastole). D. Insuffisance aortique centrale (flèche montrant le jet couleur).
D Insuffisance aortique aiguë
Elle peut être secondaire à :
• une EI en phase aiguë : IA souvent massive, consécutive à une destruction/perforation valvulaire et/ou à un abcès de l’anneau aortique (cf. fig. 8.18) ;
• une dissection aortique aiguë atteignant l’anneau aortique (cf. fig. 8.17B) ;
• un traumatisme avec lésion valvulaire aortique (traumatisme fermé du thorax, traumatisme de décélération, cathétérisme cardiaque).
E Cas particulier des insuffisances aortiques sur prothèse valvulaire
Il peut s’agir :
• d’une IA paraprothétique par désinsertion partielle septique (EI précoce ou tardive postopératoire) ou aseptique de la prothèse (anneau aortique fragilisé par des interventions multiples ou par des calcifications). L’IA paraprothétique peut parfois exister précocement après remplacement valvulaire aortique chirurgical ou TAVI (Transcatheter Aortic Valve Implantation) en dehors de tout sepsis. Elle est dans ce cas en général minime mais doit être signalée et surveillée ;
• d’une IA intraprothétique par dysfonction de prothèse (thrombus bloquant le mouvement d’une ailette, endocardite infectieuse ou dégénérescence d’une bioprothèse). Une IA minime est normale sur prothèse mécanique ou biologique.
V Clinique
A Circonstances de découverte
• La découverte est le plus souvent fortuite en cas d’IA chronique (souffle entendu lors d’une consultation pour une autre raison).
• Il peut également s’agir d’une découverte dans le cadre du bilan d’une pathologie causale.
• De nos jours, la découverte tardive au stade d’insuffisance cardiaque (IC) est devenue rare.
B Signes fonctionnels
• L’IA est souvent asymptomatique.
• On peut retrouver :
– une dyspnée d’effort (classification NYHA – New York Heart Association) ;
– rarement un angor d’effort et parfois de repos (fonctionnel) en cas d’IA massive ;
– une asthénie anormale, qui peut être la traduction de l’insuffisance cardiaque due à une IA.
• La présence de signes au repos (rares et tardifs) est de mauvais pronostic.
C Signes physiques
1 Auscultation
Elle retrouve :
• un souffle diastolique, de durée variable dans la diastole ; il débute avec le 2e bruit, va decrescendo durant la diastole et se termine avant le 1er bruit, il prédomine au foyer aortique et irradie le long du bord gauche du sternum ; il est mieux perçu lorsque le patient se penche en avant, assis ou debout. Le souffle est holodiastolique en cas d’IA importante, ou proto-mésodiastolique en cas d’IA de moindre importance ;
• un souffle systolique éjectionnel d’accompagnement au foyer aortique fréquent, En général modéré, secondaire à l’augmentation du flux antérograde transaortique ;
• un roulement de Flint apexien (sténose mitrale fonctionnelle quand l’IA gêne l’ouverture mitrale) ou bruit de galop, témoins d’une IA sévère.
2 Palpation
Elle note un choc de pointe étalé, dévié en bas et à gauche en cas de dilatation du ventricule gauche : choc « en dôme ».
3 Signes périphériques
Il s’agit :
• d’une hyperpulsatilité des pouls artériels périphériques ;
• de battements artériels parfois apparents au niveau du cou et d’autres signes d’hyperpulsatilité artérielle périphérique ;
• d’un élargissement de la pression artérielle différentielle, avec augmentation de la pression systolique et surtout abaissement de la pression diastolique traduisant une IA sévère.
VI Examens complémentaires
A Électrocardiogramme
• ![]() Il peut être normal.
Il peut être normal.
• Le rythme est en général sinusal.
• La survenue de fibrillation atriale ou d’extrasystoles ventriculaires est un élément de mauvais pronostic.
• Typiquement, on note un aspect d’hypertrophie ventriculaire gauche (HVG) (de type diastolique) avec onde R très ample dans les dérivations précordiales gauches et ondes T positives.
• On observe parfois une HVG de type systolique avec discret sous-décalage de ST et inversion des ondes T dans les dérivations précordiales gauches.
B Signes radiologiques (radiographie de thorax)
• Les IA de petit volume n’ont pas de signes radiologiques.
• Les IA volumineuses chroniques entraînent une augmentation du volume cardiaque et donc de l’index cardiothoracique.
• L’aorte, lorsqu’elle est déroulée, donne un débord aortique au niveau de l’arc moyen droit (cf. fig. 8.20).
Fig. 8.20 ![]() Radiographie de thorax de face : hypertrophie ventriculaire gauche modérée et débord de l’arc moyen sur insuffisance aortique.
Radiographie de thorax de face : hypertrophie ventriculaire gauche modérée et débord de l’arc moyen sur insuffisance aortique.
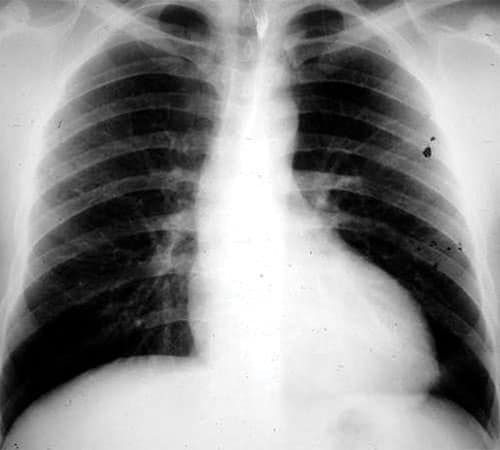
C Signes échocardiographiques
![]() L’échodoppler cardiaque permet de :
L’échodoppler cardiaque permet de :
• confirmer l’IA et d’exclure les autres causes de souffle diastolique dont l’insuffisance pulmonaire avec, au doppler couleur, visualisation d’un reflux diastolique de l’aorte vers le VG (cf. fig. 8.17D, fig. 8.18D et fig. 8.19D) ;
• quantifier l’importance de la fuite. Il existe de nombreuses méthodes de quantification, qu’il faut combiner pour éviter les erreurs. L’IA, comme l’IM, est quantifiée en 4 grades : 1, 2, 3, 4 ou minime, minime à modérée, modérée à moyenne et sévère (cf. tableau 8.3). Certaines recommandations distinguent seulement 3 grades : minime, modérée et sévère, mais ceci est discutable d’un point de vue physiopathologique car seules les fuites de grades 3 et 4 entraînent une surcharge volumétrique significative.
Tableau 8.3. ![]() Grades de l’insuffisance aortique.
Grades de l’insuffisance aortique.
| Grade de la fuite | Surface de l’orifice régurgitant – SOR (mm2) | Volume de régurgitation par battement (mL) |
|---|---|---|
| Grade 1 : fuite minime | < 10 | < 30 |
| Grade 2 : fuite minime à modérée | 10–19 | 30–44 |
| Grade 3 : fuite modérée à moyenne | 20–29 | 45–59 |
| Grade 4 : fuite sévère | 30 | ≥ 60 |
![]() La quantification repose sur :
La quantification repose sur :
– des critères indirects :
- le débit dans la chambre de chasse : une fuite sévère s’accompagne d’un hyperdébit en général avec un index > 4 L/min/m2 (cf. fig. 8.21),
- la dilatation du VG en diastole : elle signe une surcharge volumétrique significative au moins de grade 3 (cf. fig. 8.22A),
- l’effet doppler télédiastolique isthmique : la vitesse du flux rétrograde mesurée en fin de diastole dans l’isthme aortique ≥ 20 cm/s chez l’adulte est en faveur d’une IA sévère ;
– des critères directs :
- le diamètre du jet régurgitant à son origine en doppler couleur, au niveau de la zone la plus étroite ou « vena contracta » qui est un bon critère semi-quantitatif (cf. fig. 8.19D),
- la méthode de la zone de convergence ou PISA (Proximal Isovelocity Surface Area), qui s’intéresse non plus au jet régurgité, mais au flux en amont de l’orifice régurgitant ; cette méthode peut s’appliquer dans l’IA comme dans l’IM. Elle permet d’estimer la surface de l’orifice régurgitant et le volume régurgité par battement (cf. fig. 8.21) ;
• préciser le retentissement :
– dilatation du VG (cf. fig. 8.22A) :
- par la mesure des diamètres télédiastolique et télésystolique en mode TM (temps – mouvement) ou 2D, à indexer à la surface corporelle,
- par la mesure des volumes ventriculaires en mode le plus souvent bidimensionnel (ou tridimensionnel) ;
– aspect d’hypertrophie excentrique (augmentation de l’épaisseur pariétale associée à la dilatation VG) ;
– mesure de la FEVG visuelle ou par la méthode Simpson biplan : le plus souvent normale (> 50 %) dans les IA compensées (cf. fig. 8.22A) ;
– estimation des pressions de remplissage du VG ;
– mesure de la pression artérielle pulmonaire (PAP).
Dans les IA chroniques asymptomatiques, ce sont sur ces données que les indications de remplacement valvulaire reposent, ainsi que sur la dilatation éventuelle de l’aorte ascendante ;
• déterminer l’étiologie :
– mobilité des cusps ou sigmoïdes : normale, augmentée ou restreinte,
– aspect des valves, fines ou épaissies, calcifiées ou non, tricuspide ou bicuspide (cf. fig. 8.15 et fig. 8.19),
– présence de végétations ou d’abcès valvulaires est en faveur d’une EI (cf. fig. 8.18),
– mesure du diamètre de l’anneau aortique, des sinus de Valsalva et de l’aorte ascendante. En cas de maladie annuloectasiante, aspect « piriforme » ou « en bulbe d’oignon » de la racine aortique qui expose à un risque de rupture ou dissection aortique (cf. fig. 8.17A et 8.17B),
– en cas de bicuspidie, dilatation associée de l’aorte ascendante (50 % des cas environ) siégeant le plus souvent au niveau de l’aorte ascendante, au-delà de la jonction sinotubulaire,
– dilatation aortique et présence d’un « flap » en cas de dissection aortique (cf. fig. 8.17B) ;
• rechercher d’autres atteintes valvulaires associées, notamment mitrale ou tricuspide.L’échographie transœsophagienne est indiquée lorsque l’échogénicité est insuffisante en transthoracique pour quantifier la fuite ou déterminer l’étiologie, pour examiner l’aorte thoracique, ou lorsque certains diagnostics sont évoqués (EI, dissection aortique notamment).
Fig. 8.21 ![]() Critères de quantification d’une insuffisance aortique (IA).
Critères de quantification d’une insuffisance aortique (IA).
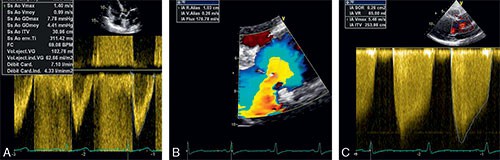
A. Une IA volumétriquement significative (grade 3 ou 4) s’accompagne d’un hyperdébit dans la chambre de chasse du ventricule gauche. B. Méthode de la PISA (Proximal Isovelocity Surface Area) avec mesure de la PISA ou zone de convergence (hémisphère en jaune). C. Mesure du flux de régurgitation aortique. Ces 2 paramètres permettent de calculer la surface de l’orifice régurgitant (SOR) et le volume de régurgitation, qui sont ici à 26 mm2 et 65 mL, respectivement, correspondant de facto à une fuite sévère.
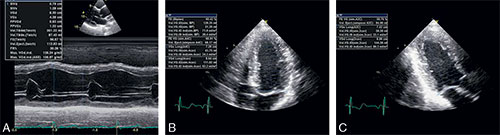
A. Mesure des diamètres VG en télédiastole (63 mm) et télésystole (44 mm) témoignant d’un remodelage excentrique dans l’insuffisance aortique. B, C. Mesure de la fraction d’éjection VG selon la méthode Simpson biplan.
D Test d’effort
• ![]() Le test d’effort n’est pas systématique mais peut être une aide à la décision thérapeutique en permettant d’apprécier la tolérance fonctionnelle. La limitation de la capacité fonctionnelle ou l’apparition de symptômes à l’effort orientent vers une prise en charge chirurgicale de l’IA.
Le test d’effort n’est pas systématique mais peut être une aide à la décision thérapeutique en permettant d’apprécier la tolérance fonctionnelle. La limitation de la capacité fonctionnelle ou l’apparition de symptômes à l’effort orientent vers une prise en charge chirurgicale de l’IA.
• Le test d’effort peut être de 3 types :
– test d’effort standard sur vélo ou tapis roulant ;
– test d’effort avec analyse des gaz expirés (épreuve d’effort métabolique : VO2) ;
– échocardiographie d’effort qui permet d’étudier l’adaptation cardiaque à l’effort.
• ![]() Les critères de mauvaise tolérance sont :
Les critères de mauvaise tolérance sont :
l’arrêt de l’effort principalement pour dyspnée et non pour épuisement musculaire ;
– une capacité d’effort (watts et/ou VO2max) < 80–85 % de la théorique ;
– un plafonnement du pouls d’O2 en fin d’effort (en VO2) ;
– un défaut de réserve contractile du VG en écho d’effort ;
– la survenue de troubles du rythme ventriculaire.
E Exploration hémodynamique
• La coronarographie préopératoire a des indications larges lorsqu’une chirurgie est envisagée, en particulier chez les hommes de plus de 40 ans et les femmes de plus de 50 ans, ou en présence de facteurs de risque cardiovasculaire.
• L’angiographie sus-sigmoïdienne est à présent exceptionnellement réalisée pour apprécier le volume de la fuite en cas de difficulté de quantification en échocardiographie.
F Imagerie en coupes (scanner et IRM)
• ![]() Le scanner a l’avantage de sa disponibilité mais l’inconvénient d’être irradiant, ce qui doit faire peser ses indications notamment en cas de répétition des examens de surveillance.
Le scanner a l’avantage de sa disponibilité mais l’inconvénient d’être irradiant, ce qui doit faire peser ses indications notamment en cas de répétition des examens de surveillance.
• L’IRM est moins disponible, mais non irradiant. Elle nécessite cependant l’injection de gadolinium, contre-indiqué en cas d’insuffisance rénale sévère.
• L’imagerie en coupes dans l’IA a surtout pour objectif de préciser les dimensions de l’aorte ascendante et d’en surveiller l’évolution chez les sujets non opérés d’emblée. La surveillance sera réalisée principalement par échocardiographie du fait de son innocuité, avec un scanner ou une IRM (fig. 8.23) en cas de dilatation déjà marquée de l’aorte ou en cas de progression vers des valeurs chirurgicales.
• L’IRM permet également de :
– déterminer les volumes VG et la FEVG (intérêt quand l’échogénicité est très mauvaise) ;
– quantifier le volume de régurgitation par différentes méthodes.
• Le coroscanner (angioscanner coronarien) peut être réalisé à la place de la coronarographie préopératoire chez les sujets jeunes sans facteur de risque cardiovasculaire.
Dilatation « en bulbe d’oignon » de la racine aortique correspondant à une maladie annuloectasiante de type syndrome de Marfan.
VII Diagnostic différentiel
• En cas de diagnostic d’un souffle diastolique, la distinction est surtout faite avec l’insuffisance pulmonaire (mais contexte différent, en général cardiopathie congénitale connue).
• Le diagnostic différentiel doit être fait avec :
un double souffle (rupture d’un sinus aortique) ;
un souffle continu (canal artériel persistant, fistule coronarienne) ;
un frottement péricardique.
• L’échographie permet habituellement d’établir le bon diagnostic.
VIII Évolution et complications
Le pronostic de l’IA est lié à son retentissement sur le VG, au risque d’EI et à l’existence éventuelle d’une dilatation de l’aorte présentant un risque de dissection ou de rupture aortique.
A Insuffisance aortique chronique
• Elle expose au risque d’EI.
• Les caractéristiques de l’IA significative (grades 3–4) sont les suivantes :
– elle peut être longtemps bien tolérée et demeurer asymptomatique ;
– l’apparition de symptômes signe un tournant évolutif de la maladie avec une altération du pronostic ;
– les lésions myocardiques associées au remodelage VG peuvent être irréversibles : l’indication opératoire est souvent posée chez des patients asymptomatiques devant la dilatation VG et/ou l’altération de la FEVG ;
– ceci impose de surveiller étroitement les sujets ayant une IA de grade 3–4.
• Le risque particulier des IA sur dilatation aortique est celui de rupture ou de dissection aortique, nécessitant de surveiller annuellement l’évolution du diamètre aortique par échographie, et de temps à autre par IRM ou scanner.
• Dans la bicuspidie aortique, le risque de dissection est un peu augmenté par rapport à la population générale mais reste faible par rapport à la maladie de Marfan.
• En cas de maladie de Marfan, le dépistage familial est recommandé ; il peut aussi être proposé en cas de bicuspidie.
B Insuffisance aortique aiguë
• Son évolution est rapide, elle est souvent mal tolérée quand l’IA est sévère.
• Il existe un risque d’OAP, voire de mort subite.
• Une chirurgie précoce est habituellement nécessaire.
C Complications
Il s’agit de :
• l’endocardite infectieuse. Sa prophylaxie (hygiène bucco-dentaire, etc.) est toujours recommandée, mais l’antibioprophylaxie n’est plus systématique avant des soins dentaires sauf en cas d’antécédent d’EI, de prothèse valvulaire ou de cardiopathie cyanogène ;
• l’insuffisance cardiaque, gauche ou globale, tardive. Elle s’observe lorsque la dilatation du VG est majeure et la fonction systolique altérée. Dans l’IA aiguë, au contraire, elle peut s’observer en l’absence de dilatation VG avec une fonction systolique préservée, par incapacité du cœur à s’adapter à une surcharge volumétrique massive brutale ;
• la dissection ou rupture aortique ;
• la mort subite, complication rare, par trouble du rythme dans les formes évoluées, ou rupture aortique en cas de pathologie de l’aorte associée.
IX Surveillance
A Insuffisance aortique chronique
• La stratégie doit s’attacher à :
– estimer le volume de la régurgitation ;
– surveiller la progression de la dilatation du VG et la FEVG ;
– surveiller la dilatation aortique ;
– prévenir une EI.
• Le rythme de suivi est de 1 à 2 fois/an s’il s’agit d’une fuite sévère, tous les 2 à 3 ans en cas de fuite modérée à moyenne, comportant :
– un examen clinique soigneux, avec recherche de symptômes, de signes d’insuffisance cardiaque ;
– un ECG ;
– un échodoppler cardiaque transthoracique ;
– éventuellement une IRM ou un scanner en cas d’IA avec dilatation importante ou progressive de l’aorte ascendante ;
– des soins dentaires 1 à 2 fois/an.
B Insuffisance aortique aiguë
• Il s’agit d’une urgence, le patient doit être hospitalisé dans un service de cardiologie à proximité d’un service de chirurgie cardiaque.
• L’IA aiguë due à une EI, à une dissection aortique ou un traumatisme est souvent très symptomatique. L’indication chirurgicale urgente ou semi-urgente est souvent nécessaire.
• L’indication chirurgicale est urgente en cas de dissection aortique, et peut être un peu différée en cas d’IA traumatique ou d’EI, en fonction de la tolérance et du contexte.
X Traitement
A Traitement médical
• Aucun traitement médicamenteux spécifique n’a démontré un bénéfice dans l’IA. En particulier, les IEC ne sont pas recommandés dans le traitement de l’IA modérée à sévère.
• Une IA sévère compliquée d’insuffisance cardiaque congestive nécessite un traitement médical (diurétiques, éventuellement IEC) dans l’attente de la chirurgie.
• La résolution des signes cliniques d’insuffisance cardiaque sous traitement médical ne doit pas faire repousser la chirurgie.
• Dans le syndrome de Marfan, et par extension quand existe une dilatation de l’aorte, les bêtabloquants sont le traitement validé pour protéger l’aorte. Les ARA2 (antagonistes des récepteurs de type 2 de l’angiotensine) peuvent être utilisés uniquement en cas d’intolérance aux bêtabloquants.
• Le sport de compétition est contre-indiqué en cas d’IA sévère, mais la pratique du sport de loisir, en particulier en endurance, est encouragée à un niveau modéré.
B Prophylaxie de l’endocardite infectieuse
La stratégie est la suivante :
• en cas de gestes à risque infectieux, en particulier dentaires :
– pas d’antibioprophylaxie systématique dans l’IA sur valves natives,
– antibioprophylaxie en cas d’antécédent d’EI, présence d’une prothèse valvulaire ou d’une cardiopathie cyanogène ;
• en revanche, une bonne hygiène dentaire et un examen dentaire tous les 6 mois sont recommandés systématiquement.
C Traitement chirurgical
1 Modalités
• L’IA isolée est traitée par remplacement valvulaire aortique (RVA) simple avec implantation d’une prothèse mécanique ou biologique. Le choix de la prothèse doit être discuté entre le patient et le chirurgien, le choix final revenant au patient, sauf en cas de contre-indication claire à l’un des types de prothèse. La prothèse biologique est généralement implantée après 60–65 ans ou chez la femme souhaitant une grossesse, mais sa mise en place plus tôt dans la vie est possible sur demande du patient. Le patient doit être prévenu de la nécessité d’une réopération en général 10 ans plus tard du fait de la dégénérescence des prothèses biologiques.
• L’IA avec dilatation aortique est traitée par RVA associé à un remplacement de l’aorte ascendante par tube prothétique avec réimplantation des coronaires (Bentall), ou parfois tube sus-coronaire sans avoir à réimplanter les coronaires.
• La réparation valvulaire aortique (plastie chirurgicale conservatrice) n’est pratiquée que par certains chirurgiens entraînés en cas de normalité des feuillets valvulaires si l’IA est due à une dilatation de la racine de l’aorte, et dans certains cas de prolapsus. Elle comporte un remplacement de l’aorte initiale avec réimplantation coronarienne (Tirone David, Yacoub).
2 Indications
Les indications chirurgicales reposent essentiellement sur les données cliniques et échographiques. Les indications reconnues sont (cf. tableau 8.4) :
• l’IA chronique sévère symptomatique (dyspnée, insuffisance cardiaque congestive) ;
• l’IA chronique sévère asymptomatique avec :
– un diamètre télésystolique > 50 mm ou > 25 mm/m2 en échographie,
– ou une FEVG ≤ 50 % ;
• l’IA chronique sévère asymptomatique, si la chirurgie est considérée à bas risque chez le patient, avec :
– un diamètre télésystolique > 20 mm/m2 en échographie,
– ou une FEVG ≤ 55 % ;
• l’IA chronique sévère asymptomatique si une chirurgie cardiaque est envisagée pour des pontages coronariens, pour une dilatation de l’aorte, ou pour une autre valvulopathie ;
• l’IA, quel que soit son grade, avec dilatation de l’aorte ascendante lorsque :
– le diamètre de la racine de l’aorte, quelle que soit la zone de mesure, est ≥ 55 mm, ou ≥ 50 mm dans le cas du syndrome de Marfan,
– le diamètre peut être ramené à 45 mm en cas de syndrome de Marfan avec facteurs de risque de rupture ou de dissection, ou à 50 mm en cas de bicuspidie avec facteurs de risque (HTA non maîtrisée, histoire familiale ou personnelle de dissection, progression rapide de la dilatation > 3 mm/an, IM ou IA sévère, désir de grossesse) ;
• l’IA aiguë sévère : l’indication opératoire est formelle et urgente en cas de signe d’insuffisance cardiaque ;
• l’EI, qu’elle soit sur valve native ou sur prothèse. L’indication chirurgicale doit être discutée notamment en présence d’un sepsis non maîtrisé, d’une insuffisance cardiaque, ou s’il existe un risque embolique majeur devant de très volumineuses végétations.
Tableau 8.4. ![]() Indications chirurgicales dans l’insuffisance aortique (IA).
Indications chirurgicales dans l’insuffisance aortique (IA).
| Situation | Indication |
|---|---|
| IA sévère (grade 4) | |
| Patient symptomatique (dyspnée, angor) | Formelle |
Patient asymptomatique si :
|
Formelle |
Patient asymptomatique si :
|
Devrait être posée si faible risque chirurgical chez le patient |
| Chirurgie cardiaque pour une indication (pontage coronarien, aorte ascendante, autre valve) | Formelle |
| Chirurgie de l’aorte quel que soit le grade de l’IA | |
| Dilatation de l’aorte ascendante ≥ 50 mm si syndrome de Marfan | Formelle |
| Dilatation de l’aorte ascendante ≥ 55 mm | Devrait être posée |
| Dilatation de l’aorte ascendante ≥ 45 mm si syndrome de Marfan avec facteurs de risque1 | Devrait être posée |
| Dilatation de l’aorte ascendante ≥ 50 mm si bicuspidie avec facteurs de risque1 | Devrait être posée |
| Lorsque la valve aortique est opérée pour une IA sévère l’aorte ascendante devrait être remplacée si ≥ 45 mm | Devrait être posée |
FEVG : fraction d’éjection ventriculaire gauche ; HTA : hypertension artérielle ; IM : insuffisance mitrale ; VG : ventricule gauche.
1Antécédent familial ou personnel de dissection aortique spontanée, IA ou IM sévère, désir de grossesse, HTA systémique non contrôlée, augmentation du diamètre de l’aorte > 3 mm/an lors de mesures comparatives échographiques ou IRM confirmées par scanner synchronisé.
© Adapté de Lancellotti P, Tribouilloy C,Hagendorff A, Popescu BA, Edvardsen T, Pierard LA, et al. Recommendations for the echocardiographic assessment of native valvular regurgitation : an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013 ; 14 : 611-44.
in Médecine cardiovasculaire, les Référentiels des Collèges, CNEC, SFC, 2022, 2e édition, Elsevier Masson
3 Bilan préopératoire
• Il doit permettre d’évaluer le risque opératoire, et de déterminer précisément le geste chirurgical à réaliser (geste associé sur les coronaires, sur l’aorte, etc.).
• Il comporte en général :
– une imagerie des coronaires (coronarographie ou coroscanner) ;
– un scanner ou une IRM de l’aorte en cas de dilatation aortique ;
– un échodoppler des troncs supra-aortiques ;
– la recherche de foyer infectieux de la sphère ORL (sinusite) ou stomatologique (foyers infectieux dentaires) avec radiographie des sinus et panoramique dentaire ;
• la recherche de comorbidités (fonction rénale, pathologie pulmonaire, etc.) ;
• un avis gériatrique (patient fragile > 75 ans) pour peser le rapport bénéfice/risque de l’opération.
4 Résultats
• ![]() Les résultats des séries chirurgicales actuelles sont excellents, les patients étant opérés à un stade moins évolué qu’autrefois.
Les résultats des séries chirurgicales actuelles sont excellents, les patients étant opérés à un stade moins évolué qu’autrefois.
• La mortalité périopératoire n’excède pas 1 à 3 % en cas de RVA isolé chez les patients asymptomatiques.
• Elle atteint 3 à 10 % chez les patients symptomatiques, ou en cas de chirurgie de l’aorte ascendante ou de pontages coronariens associés.
D Remplacement valvulaire percutané (TAVI)
• ![]() Un remplacement valvulaire percutané est parfois proposé dans l’IA chez des patients à très haut risque chirurgical ou pour lesquels la chirurgie est contre-indiquée, en l’absence d’EI.
Un remplacement valvulaire percutané est parfois proposé dans l’IA chez des patients à très haut risque chirurgical ou pour lesquels la chirurgie est contre-indiquée, en l’absence d’EI.
• Les prothèses actuelles ne sont pas cependant pas conçues pour cette pathologie (les prothèses TAVI s’accrochent sur les calcifications), avec notamment un risque de migration après implantation, si bien que cette solution reste actuellement très marginale.
| Item 17. Télémédecine, télésanté et téléservices en santé • • La pratique de l’échocardiographie évolue. Cet examen peut être réalisé dans certains centres par un technicien d’échocardiographie sous la supervision d’un cardiologue (et interprétation à distance par un cardiologue en télémédecine), ou encore par l’intermédiaire d’un robot contrôlé à distance. |
| Item 18. Santé et numérique |
Points-clés
| • L’insuffisance aortique est une valvulopathie peu fréquente. Elle est le plus souvent chronique, mais des formes aiguës existent, notamment en cas d’endocardite infectieuse. • L’IA sur dilatation de la racine de l’aorte, notamment dans sa forme annuloectasiante, avec normalité des valves aortiques est une étiologie fréquente dans les pays occidentaux. La dilatation de la racine de l’aorte et/ou de l’aorte initiale entraîne une perte de contact des valves aortiques. • L’IA annuloectasiante comporte un risque de dissection ou de rupture de la paroi aortique. L’indication opératoire peut donc être portée non pas sur l’importance de la fuite, mais sur le diamètre de l’aorte ascendante pour prévenir le risque de dissection. La bicuspidie aortique (1 à 2 % de la population) est une cause fréquente d’IA par prolapsus de la cusp la plus grande. La bicuspidie expose au risque de sténose aortique à tout âge, à l’IA et à l’EI. Du fait d’anomalies histologiques associées de la paroi de l’aorte ascendante, elle comporte un risque de dilatation aortique ou rarement de dissection aortique. • L’IA chronique est une valvulopathie qui peut rester silencieuse, asymptomatique pendant de nombreuses années. Lorsque les symptômes apparaissent, la situation est déjà évoluée, le ventricule gauche est le siège d’un remodelage avec lésions de fibrose, qui peuvent persister après remplacement valvulaire aortique. • De ce fait, on est souvent amené à opérer des IA chroniques alors que les patients sont asymptomatiques. L’indication opératoire est portée essentiellement sur des critères cliniques et échocardiographiques : présence de symptômes, dilatation du VG > 50 mm en systole (ou 25 mm/m2, indexé à la surface corporelle du patient), fraction d’éjection abaissée < 50%, ou dilatation de l’aorte ascendante importante. • • Un dépistage familial est formellement indiqué en cas de syndrome de Marfan, proposé en cas de bicuspidie aortique. • L’IA aiguë est due le plus souvent à une EI, plus rarement à une dissection aortique ou à un traumatisme ; elle est généralement très symptomatique et une indication chirurgicale rapide est habituellement retenue. • Il n’existe pas de traitement médical dans l’IA sévère. • La chirurgie de l’IA peut s’appuyer sur une réparation valvulaire avec remplacement de l’aorte initiale, mais consiste le plus souvent en un remplacement valvulaire, associé ou non au remplacement de l’aorte ascendante. La désinsertion, puis la réimplantation des coronaires sur la prothèse de l’aorte peuvent être nécessaires. • Le remplacement percutané de la valve aortique n’est pas un traitement de l’IA. Il est parfois proposé en cas de très haut risque chirurgical dans l’IA, en l’absence d’EI, mais cette technique n’est pas adaptée à cette situation et reste exceptionnelle. • L’IA expose au risque d’endocardite infectieuse. Alors que l’antibioprophylaxie systématique n’est plus indiquée, la prophylaxie reste importante (hygiène bucco-dentaire, etc.). |
Notions indispensables et inacceptables
Notions indispensables
• L’insuffisance aortique est une valvulopathie peu fréquente qui peut rester asymptomatique pendant de nombreuses années.
• Les principales étiologies d’IA dans les pays occidentaux sont :
- la dystrophie valvulaire aortique ;
- la dilatation de l’aorte, notamment sur maladie annuloectasiante (penser au Marfan), avec risque de dissection ou de rupture de l’aorte ;
- la bicuspidie aortique (1 à 2 % de la population), cause fréquente d’IA. La bicuspidie expose au risque de sténose aortique à tout âge, à l’IA et à l’endocardite infectieuse, et peut s’accompagner d’une dilatation aortique ;
- l’EI.
• L’IA aiguë est le plus souvent due à une EI, plus rarement à une dissection aortique ou à un traumatisme.
• La découverte d’un souffle d’IA requiert un avis cardiologique que le patient soit symptomatique ou asymptomatique.
• La surveillance des patients porteurs d’IA importante doit être régulière, tous les 6 mois à 1 an, par un cardiologue.
• Le syndrome de Marfan nécessite un dépistage familial.
• Il n’existe pas de traitement médicamenteux efficace dans l’IA sévère.
• L’indication opératoire de l’IA sévère repose sur des critères cliniques et/ou échocardiographiques.
• L’IA aiguë est souvent très symptomatique et conduit à la chirurgie.
• La chirurgie de l’IA consiste en une réparation ou remplacement chirurgical de la valve aortique. Le remplacement percutané (TAVI) n’est pas un traitement de l’IA.
• La prophylaxie de l’EI est importante dans l’IA (hygiène bucco-dentaire, etc.).
Notions inacceptables
• Ne pas penser à l’endocardite infectieuse devant une IA aiguë fébrile.
• Ne pas penser à la dissection aortique devant une IA aiguë chez un patient ayant présenté une douleur thoracique ou un AVC sans fièvre.
• Ne pas évoquer la maladie de Marfan devant une IA avec maladie annuloectasiante.
• Ne pas référer à un spécialiste un patient porteur d’une IA symptomatique.
• Ne pas référer à un spécialiste un patient porteur d’une IA asymptomatique.
• Traiter une IA symptomatique uniquement par des médicaments de l’insuffisance cardiaque.
• Indiquer à un patient que l’IA se traite par technique percutanée.
• Ne pas indiquer au patient de réaliser une prophylaxie de l’EI.
• Prescrire de façon systématique des antibiotiques avant tout soin dentaire chez un patient porteur d’une IA.
Réflexes transversalité
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

CARDIOLOGIE PÉDIATRIQUE Percutaneous Edge-to-Edge Repair of Atrioventricular Valves in Congenital Heart Disease: A Multicenter [...]

CARDIOLOGIE PÉDIATRIQUE Tricuspid valve surgery in transposition of the great arteries with a systemic [...]


